A l 'aide de ces deux données (numéro et masse), il est donc facile d'en déterminer la composition en protons, neutrons et électrons.
|
L'ELEMENT est un type d'atome caractérisé par un symbole chimique et un numéro atomique. Ils sont classés dans le tableau périodique des éléments : chaque case contient un élément.
A chaque case, on ajoute un proton (et donc un électron pour conserver la neutralité des atomes). Les éléments sont donc caractérisés par un nombre de protons unique (et d'électrons donc). |
Par contre, on peut avoir pour un même élément, des atomes contenant un nombre de neutrons différents, on appellera chaque "sous-élément" un NUCLEIDE. Un nucléide, est lui défini par son symbole, son numéro atomique et par sa masse atomique.
On dira que chaque nucléide d'un élément est isotope des autres nucléides du même élément (c'est une relation entre eux, comme être le frère de ... ou la soeur de .... ).
Un nucléide est caractérisé à la fois par :
|
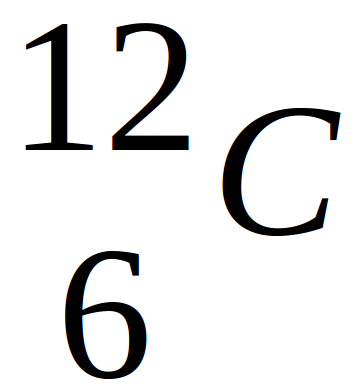 |
A l 'aide de ces deux données (numéro et masse), il est donc facile d'en déterminer la composition en protons, neutrons et électrons.
L'élement carbone possède 3 isotopes : le carbone 12, le carbone 13 et le carbone 14. Comme ce sont tous des nucléides du carbone, ils ont tous :
Leur différence de masse provient de leur composition différente en neutrons, respectivement 6, 7 et 8.
 |
 |
 |
 |
 |
| 3 nucléides | 1 élément | |||
Dans le tableau périodique, ils sont tous les 3 rassemblés en une seule case, appelée "carbone", c'est l'élément. La masse attribuée à cet élément est appelée masse atomique.
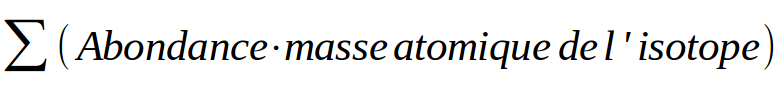
Pourquoi fonctionner ainsi ? Simplement parce que si je prend x grammes d'un élément, je vais très certainement retrouver les différents isotopes qui existent dans la nature en quantité globalement similaire à leur abondance.
Cette valeur représente la masse atomique. Elle est exprimée en Unité de Masse Atomique (U.M.A). L'U.M.A représente le douzième de la masse du nucléide 12C.
Pour qu'elle soit RELATIVE il faut la diviser par 1 U.M.A de telle façon à ce que la masse atomique relative n'ait pas d'unités !
 |
Cette formule permet aussi de calculer les paramètres isotopiques, si on connait la masse atomique relative. C'est une variante d'exerice. En vous fournissant la masse atomique relative et toutes les informations sur les isotopes sauf une, vous pouvez facilement retrouver la donnée manquante. |
 |
Dans les cases du tableau périodique, on indique souvent le numéro atomique en haut de la case et la masse en bas de la case ... Dans la notation d'un nucléide, c'est le contraire ... La masse est au dessus et le numéro atomique en dessous. C'est ainsi ... Autant le savoir pour ne pas se tromper ! |