Définissons un voisin comme une densité électronique présente dans une direction de l'espace. Un voisin cela peut donc être un doublet libre sur un atome, une liaison simple mais aussi une liaison double ou triple.
Il nous suffit alors de les comptabiliser et de se référer au tableau suivant qui donne la meilleure façon d'éloigner au maximum ces voisins.
| La liaison de deux atomes donne nécessairement une molécule linéaire. Dans la molécule suivante, chaque atome a un voisin |
| Lorsqu'un atome fait deux liaisons, il a deux voisins. Géométriquement, pour les éloigner le plus possible, il les place à 180° l'un de l'autre. La molécule est donc toujours linéaire. |
|
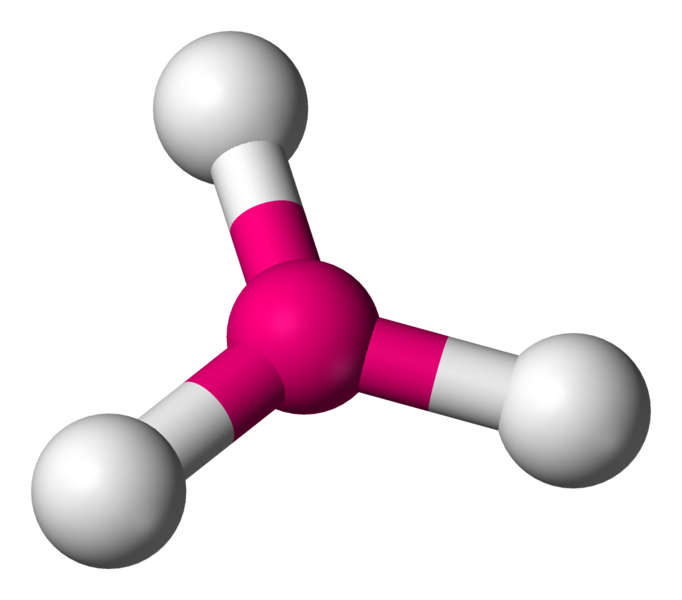
Lorsqu'un atome fait trois liaisons, il a trois voisins. Géométriquement, pour les éloigner le plus possible, il les place à 120° l'un de l'autre. La molécule est donc triangulaire ... et plane.
|
|
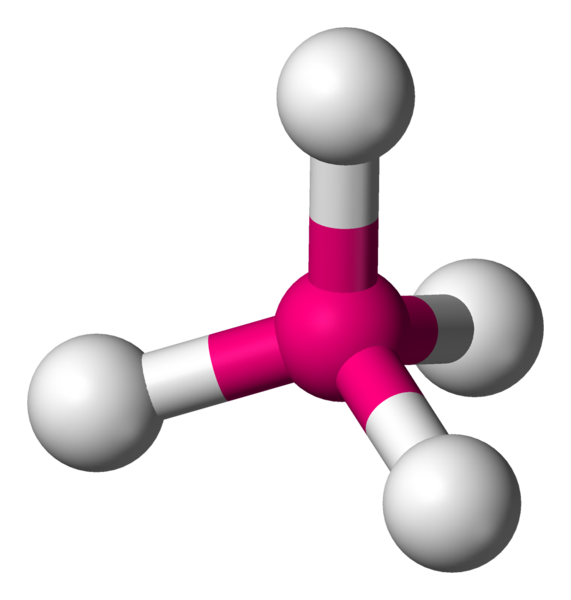
Quand il faut lier 4 voisins, il faut alors utiliser les 3 dimensions de l'espace. Géométriquement, pour les éloigner le plus possible, il faut les éloigner chacun d'un angle de 109,4°. La forme particulière obtenue est appelée tétraèdre.
|
|
Avec 5 voisins, les minimum d'interactions, se réalise en plaçant 3 atomes dans un plan à 120° comme dans la géométrie triangulaire plane. Comme il reste une place au dessus et en dessous du triangle, il y a la place pour fixer de part et d'autre du triangle les deux atomes restants. On appelle cela une bipyramide à base triangulaire.
|
|
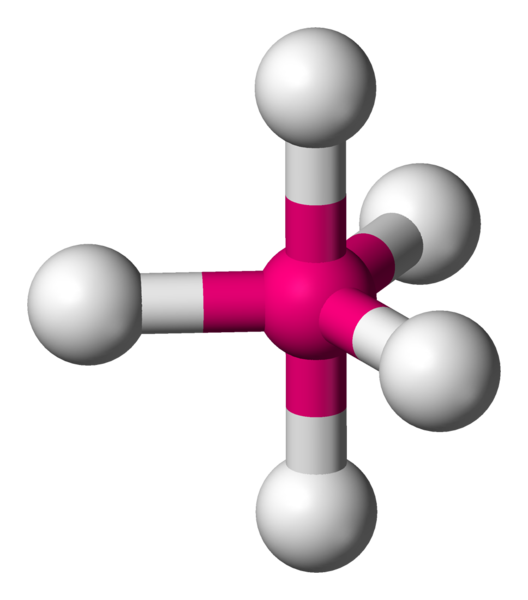
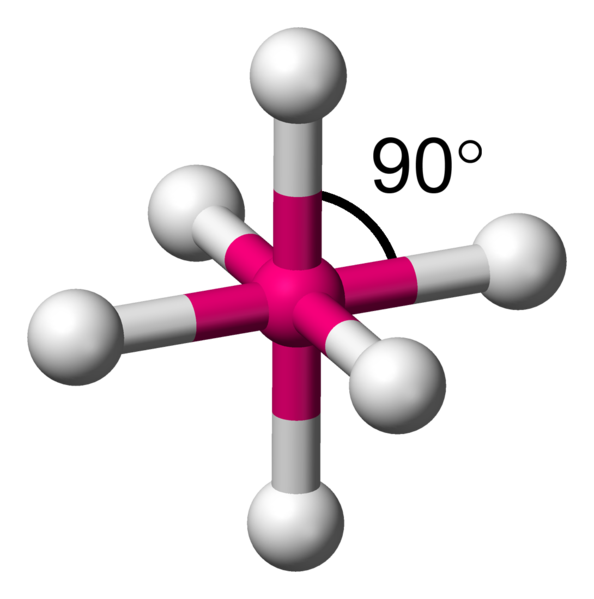
Avec 6 voisins, les minimum d'interactions, se réalise en plaçant 4 atomes dans un plan à 90°.Comme il reste une place au dessus et en dessous du carré formé, il y a la place pour fixer de part et d'autre les deux atomes restants. On appelle cela une bipyramide à base carrée.
|
Ceci nous donne la géométrie de l'atome central qui peut différer de celle de la molécule si il y a des doublets libres sur l'atome.
De plus, comme nous considérons comme un seul et même voisin un doublet libre basé sur l'atome (et donc qui l'encombre plus) ou une liaison dont la densité électronique est déportée plus loin de l'atome, nous devons apporter une correction aux angles. En effet, deux doublets libres se repoussent plus que ce que se repoussent un doublet libre et une liaison. Finalement deux liaisons se repoussent moins.
|
Prenons l'exemple de la molécule d'eau (H2O) :
L'animation de droite montre une molécule d'eau (sans les doublets représentés) avec au départ un angle de 109,4°, puis l'optimisation de l'angle en prenant en compte les répusions. On obtient alors une molécule coudée.
|