Apprendre
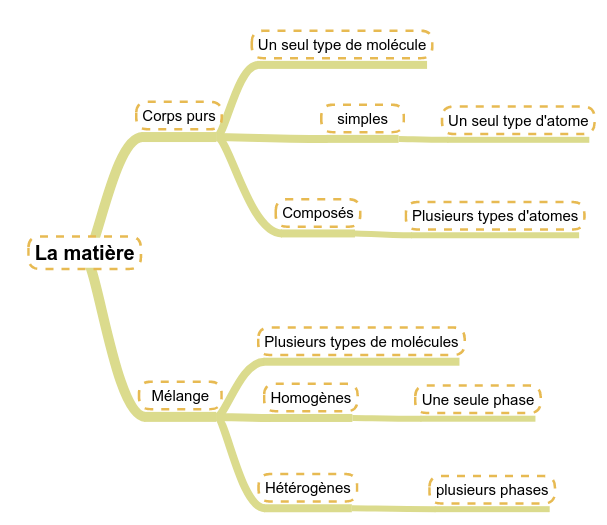
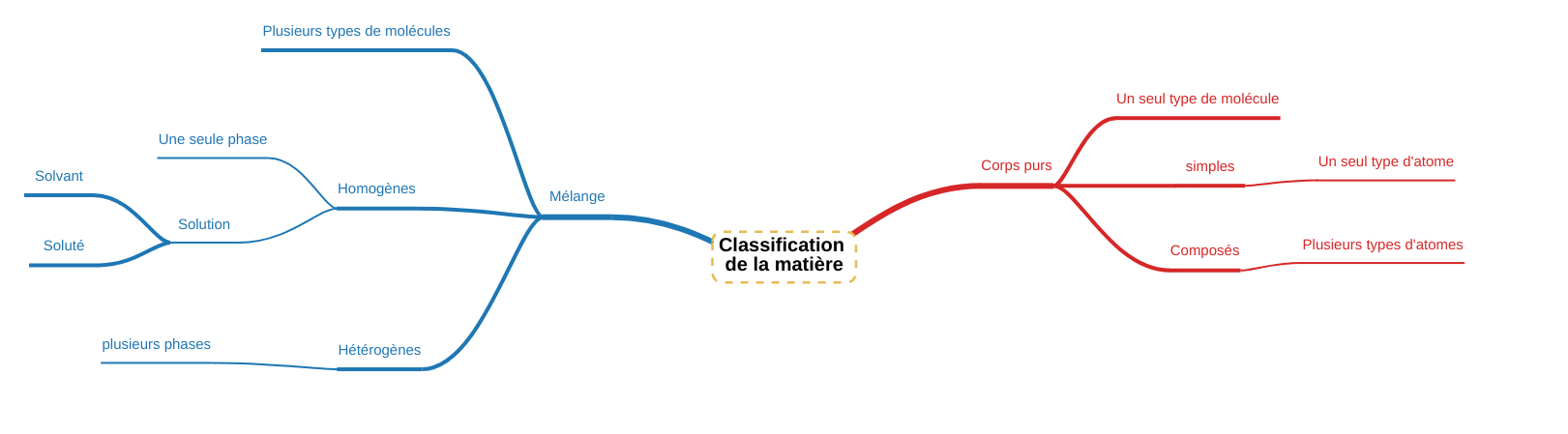
En fonction de sa composition moléculaire, nous pouvons classer la matière en différentes grandes familles. Cette classification amènera des propriétés différentes : Tout d'abord, nous distinguerons : En regardant chacun de ces types de corps, nous pouvons encore les différencier :
Mélange homogène
Mélange hétérogène
 |
Un mélange très important : la solution |
||||
|
Une solution est un mélange homogène (souvent liquide mais pas nécessairement, on peut avoir des solutions solides ou gazeuses ... ) d'au moins deux corps :
Il peut y avoir plusieurs solutés dans une solution mais il n'y aura qu'un seul solvant. |
Au niveau moléculaire, une solution est un mélange intime entre les molécules du solvant et les molécules (ou les ions) du soluté. Cela sous entend qu'il y a des interactions moléculaires entre le solvant et le soluté. Une solution ne peut donc se réaliser que si les différentes molécules font des interactions compatibles ... Soit les deux sont non polaires, soit les deux sont polaires, soit les deux possèdent des parties polaires et non polaires. Le phénomène menant à la formation de la solution s'appelle la SOLVATATION, les molécules du solvant vont entourer les particules (molécules ou ions) de soluté. L'exemple suivant montre la dissolution d'un morceau de sel de cuisine (chlorure de sodium) dans de l'eau. L'eau sépare les ions Na+ et Cl- et les entourre (Solvatation). L'eau de par sa polarité, montrera donc aux ions + son pôle négatif (l'atome d'oxygène) et aux ions -, son pôle positif (ses atomes d'hydrogène).
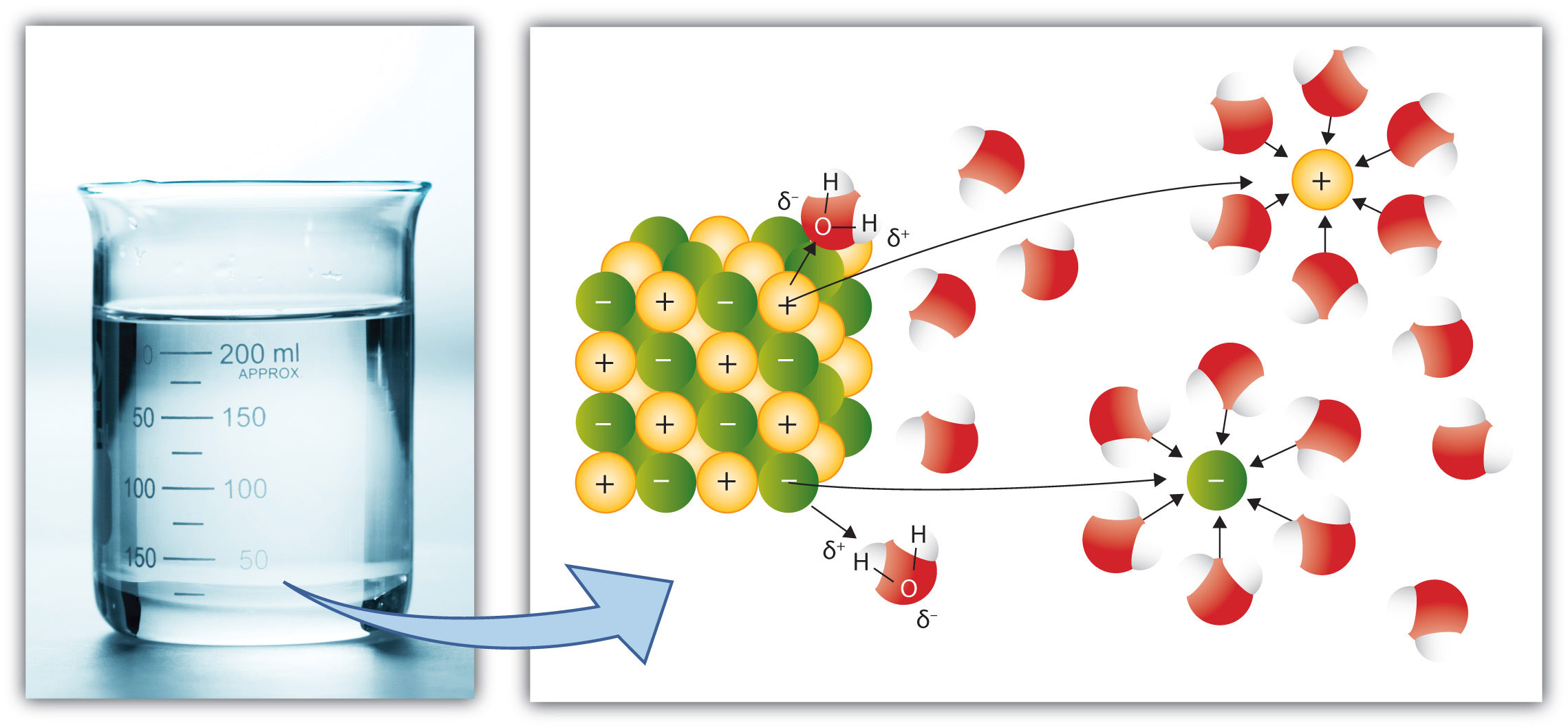
By Andy Schmitz (http://2012books.lardbucket.org/) [CC BY 3.0 (https://creativecommons.org/licenses/by/3.0)], via Wikimedia Commons
 |
La concentration |
||||
La composition d'une solution est souvent caractérisée par la concentration. La concentration est un concept qui nous permet de connaître la quantité de soluté présente dans une certaine quantité de solution.
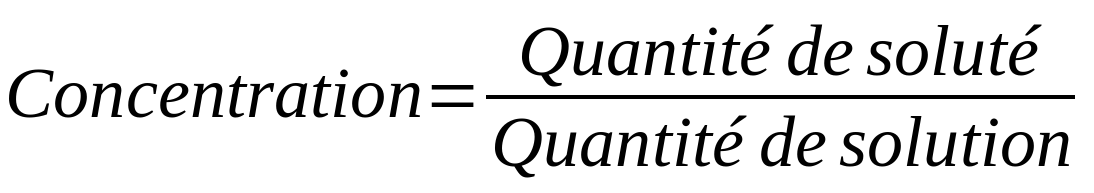
Il existe différents types de concentrations en fonction du paramètre utilisé pour caractériser la quantité (masse, mole, volume) :
- La concentration massique (ou pondérale)
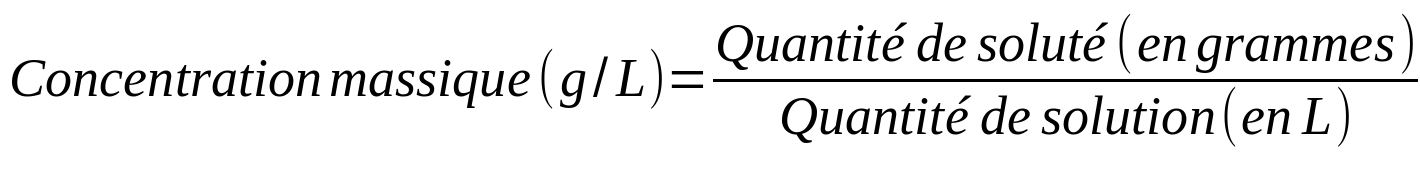
- La concentration molaire
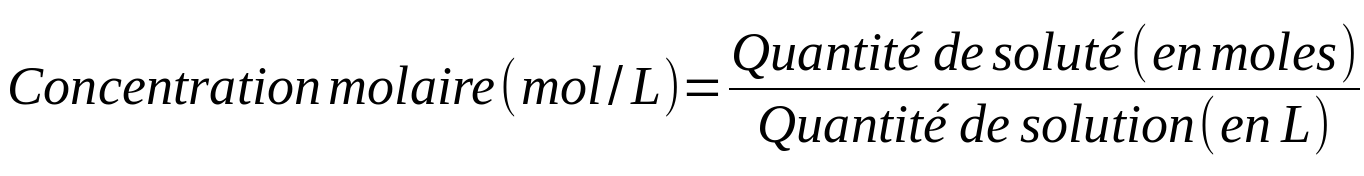
- La concentration molale
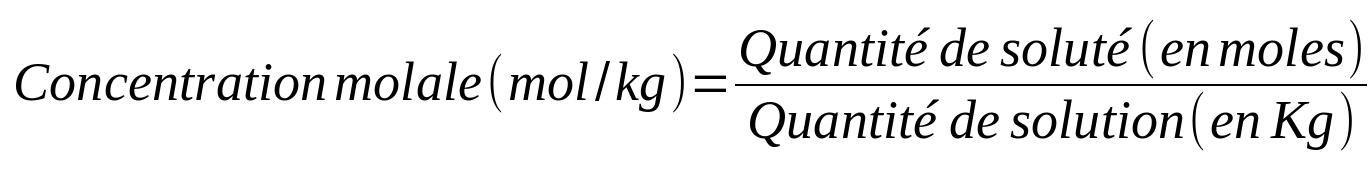
 |
Parce que le chimiste utilise souvent la concentration molaire, il a réduit la notation de son unité. Ainsi, des mol/L peuvent s'écrire M ... que le chimiste lira 'molaire'. Une solution de concentration égale à 3 mol/L peut donc s'écrire aussi 3M et sera dite 3 molaire. |