Apprendre
|
Nous avons décrit les états de la matière. Il est possible de passer de l'un a l'autre en changeant des paramètres. C'est l'étude microscopique qui va nous aider à comprendre comment ces paramètres vont influencer ces changements d'état.
Ci-contre, une vidéo montrant l'effet Mpemba. Cet effet met en avant que l'eau chaude peu geler plus rapidement que de l'eau froide dans certaines conditions.
|
|
|
Découvrir les changements d'états
Avant de comprendre comment cela se passe; il est important de connaître les différents changements d'état. Sur l'image suivante, vous pouvez retrouver un certain nombre de changements d'états courants.
 |
|
Il reste deux transformations sur lesquelles il est important de s'arrêter un peu plus longuement.
Il est en effet possible de transformer un solide en gaz, sans passer par le liquide. Cette transformation s'appelle la sublimation. L'inverse est aussi possible, le gaz se condense en solide, c'est une condensation solide.
Toutes les substances ne le permettent pas ... mais il est assez facile de l'observer avec le dioxyde de carbone ou l'iode. La vidéo ci-contre montre de la neige carbonique (CO2 solide) se sublimant à pression et température ambiante.
|
|
|
Une application des changements d'états : la purification de l'iode par sublimation
L'iode est connue pour se sublimer facilement. A la fin d'une manipulation de synthèse d'iode, sa purification en est simplifiée. Il suffit de faire chauffer l'iode impure synthétisée et de la chauffer légèrement. Des vapeurs mauves caractéristiques se dégagent alors du solide ... Aucun liquide n'est présent.
L'iode se condense alors sur les surfaces froides disponibles. Il suffit d'en récolter les cristaux.
|
A partir du travail de NeilRed - Youtube
|
 |
Les paramètres influençant les changements d'état
|
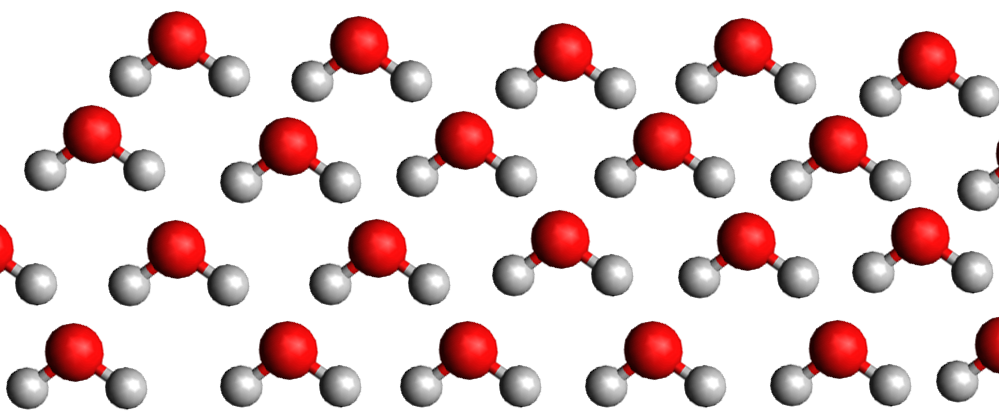
Si l'on reprend les représentations moléculaires des différents états, on remarque que ce qui les différencie est :
- le mouvement des particules
-
l'espace entre les particules
Pour augmenter le mouvement des particules, il faut leur donner de l'énergie afin d'augmenter leur agitation. C'est possible à l'aide d'un apport en énergie thermique. Le paramètre mesurable sera LA TEMPERATURE. Une augmentation de température favorisera LA FUSION et LA VAPORISATION.
L'espace entre les molécules peut être favorisé par une variation de LA PRESSION. Une augmentation de la pression favorisera LA CONDENSATION et LA SOLIDIFICATION.
Il y a donc systématiquement des couples de valeurs de pression et de température pour lesquels un corps est solide, liquide ou gazeux. Certaines valeurs particulières amènent à des changements d'état (fusion, vaporisation, ...).
Quelques exemples
A 20°C et 1 atmosphère l'eau est liquide
A -4°C et 1 atmophère, l'eau est solide
Mais à 0°C et 1 atmosphère, il y a un équilibre entre l'eau solide et l'eau liquide
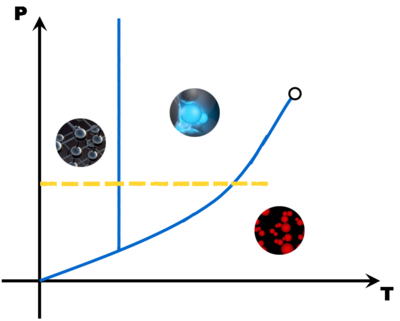
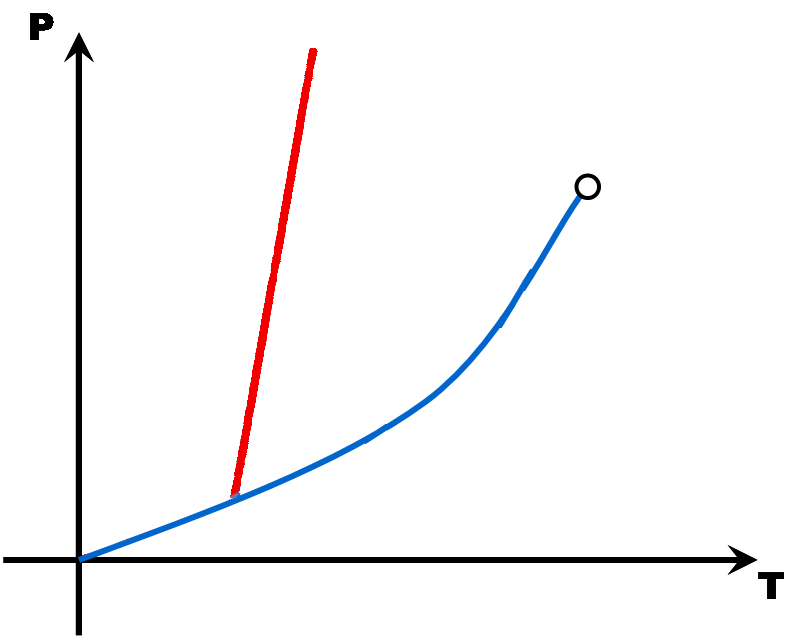
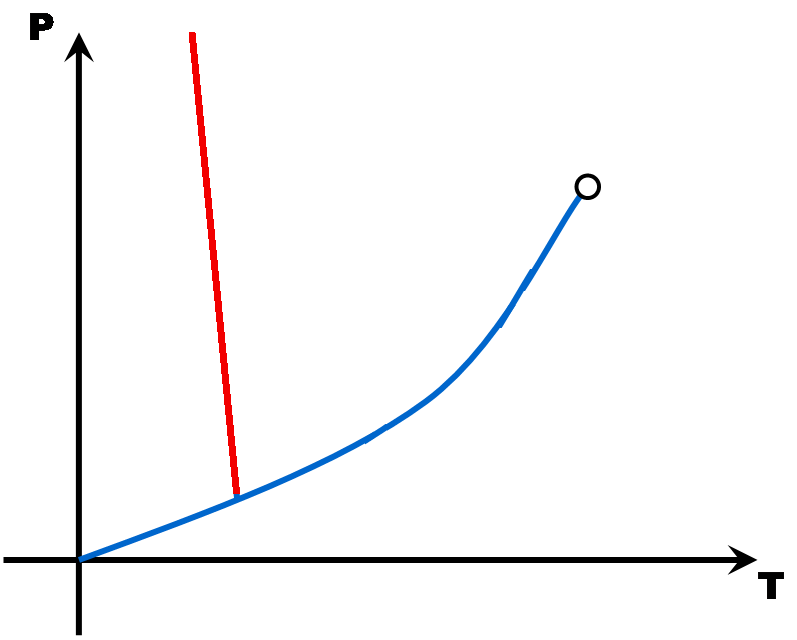
Avec tous ces couples pression - température, on peut construire un diagramme (appelé diagramme d'état) qui montre trois grandes zones, une pour chaque état de la matière. A la limite de deux zones, une droite ou une courbe matérialise l'équilibre entre deux états (le changement d'état).
 |
|
Avec quelques points (Point triple, point critique, point de fusion, point d'ébullition et éventuellement le point de sublimation), il est possible de tracer une esquisse du diagramme d'état d'une matière. Comme en math, il faut juste deux points par droite ou par courbe ...
Ces diagrammes sont utiles pour savoir sous quel état est une matière en fonction des conditions de pression et de température.
|
 |
|
La pente de la droite de fusion (rouge) est toujours positive (droite penchée vers la droite) .. Sauf pour l'eau dont la pente de la droite de fusion est négative (droite penchée vers la gauche).
Eau liquide
Eau solide
|
|
| |
Pourquoi une telle différence ?
La densité de la glace est plus faible que celle de l'eau liquide car la structure moléculaire du liquide est plus compacte que celle du solide. C'est exceptionnel ... C'est le contraire pour les autres matières.
Ce qui a comme conséquence :
| La glace flotte sur l'eau |
|
| La glace occupe plus de volume que l'eau |
|
|
L'augmentation de pression fait fondre la glace
|
| C'est une propriété intéressante de l'eau, qui a permis l'apparition de la vie ! En effet, la glace flotte, créant une couche isolante au dessus des lacs, protégeant ainsi la vie aquatique. Dans le cas contraire, les lacs seraient transformés en bloc de glace, tuant la vie. |
|
Quand l'eau gèle, elle prend plus de place. Dans un tuyau rempli d'eau par exemple, le gèle amène une forte augmentation de pression dans le tuyau amenant des ruptures de canalisation. |
|
Le fil traverse la glace car la masse des poids suspendus n'est répartie que sur la petite surface du fil. Il en résulte donc une force importante. La glace fond en dessous du fil et l'eau regèle instantanément une fois le fil passé. Le fil peut traverser ainsi le bloc sans le couper !
|
| |
|
|
|
A partir d'une émission des Incroyables Expériences
France 2 - R&G Productions
|
Revoir la théorie
Les résumés sont construits autour d'une carte heuristique (mindmap) simplifiée qui représente le plan de la connaissance à maîtriser concernant le sujet central. Chaque branche de cette carte représente une question potentielle que l'on peut vous poser sur la matière.
Au bout de chaque branche, un logo montre que quelque chose est attaché. Il s'agit du reste de la carte qui s'ouvre dans un popup.
Chaque partie de la carte est "lue" : un texte est proposé en guise de "réponse".
Revoir, c'est s'entraîner à générer ce que contiennent les différents popup
A venir
Ludo Apprentissage
A venir
Drill : augmenter son expertise de savoir-faire
A venir