|
Quelques définitions
|
Nous en parlons depuis le début mais il est bon d'expliquer ce que sont les acides et les bases. Ces propriétés sont liées à la structure des molécules.
Une ancienne théorie de l'acidité définissait un acide comme un donneur de proton (H+) et une base, une donneuse d'ions hydroxyde. Cette théorie fort limitée formulée par Arrhénius ne prend pas en compte les bases non hydroxylées (sans fonction OH).
La théorie la plus utilisée est celle de Bronsted pour qui :
-
Un acide donne des H+ (proton)
-
Une base capte des H+
L'acidité, d'une solution va donc être caractérisée par la concentration en ions H+ qui sera plus importante pour les solutions acides (puisqu'ils produisent des ions H+) et beaucoup plus faible pour des solution basiques. L'acidité est caratérisée par un paramètre caliculable et mesurable, le pH. Les protons ne se déplaçant pas seuls en solution (mais à dos de molécules d'eau), on considèrera pour être totalement exact l'ion H3O+ comme vecteur de l'acidité en solution aqueuse.
\[ \Large pH = - log([H^+])\]
Une autre vision plus globale existe
Certaines molécules acides ne peuvent pas répondre aux définitions de Bronsted car leur structure ne possède pas d'hydrogène. Pourtant ce molécules ont un caractère acide. Ainsi de nombreux oxyde métalliques (CO2, SO3, ...) et des sels (AlCl3, FeBr3, ...) ont des caractéristiques acides. Dans ces conditions, il nous faut modifier notre vision des acides. On va la globaliser en se basant sur le principe qui sous tend toute réactions chimiques : le transfert d'électrons.
Nous pouvons alors modifier les définissions des acides et des bases en disant que :
- Un acide accepte un doublet d'électron (Donner H+, c'est aussi confisquer un doublet à la base afin de lier H+)
- Une base donne un doublet électronique (C'est effectivement ainsi que la base peut capter un H+)
C'est la théorie de l'acidité de Lewis qui ne fait que globaliser la vision de Bronsted. Les deux visions sont compatibles et donnent le même classement des acides et des bases. Lewis devient utile lorsque la théorie de Bronsted n'est plus applicable ...
 |
L'eau dans tout cela ?
|
L'eau, le solvant de nos solutions et de nos réactions, n'est pas une molécule inerte. Elle va s'adapter à la présence de solutés ... La première adaptation que nous avons vue est la solvatation (elle aide à éloigner les particules polaires ou chargées). Une autre action de l'eau est sa capacité à réagir ... dans certaines conditions ... Nous avons déjà parlé de son rôle dans .
Lorsque l'eau est en présence d'un acide ou d'une base, elle est capable de réagir avec ces derniers, on peut expliquer cela par sa structure moléculaire ...
|
L'atome d'oxygène possède deux doublets qui peuvent être partagés. Ainsi, lorsque des ions H+ sont à proximité, il peut y avoir annexion de ce dernier et la formation d'un nouvel ion H3O+.
\[ \Large H_2O + H^+ \longrightarrow H_3O^+\] |
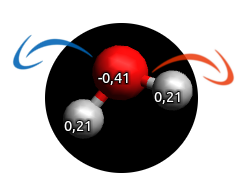 |
La liaison O-H est une liaison polarisée. Nous voyons que l'hydrogène porte une charge positive.
Cette polarisation permet de comprendre que cette liaison peut se casser :
\[ \Large H_2O \rightleftarrows H^+ + OH^-\]
|
 |
|
Parce que l'eau a tendance à capturer les ions H+, nous écrirons automatiquement H3O+ qui est le vecteur de l'acidité dans l'eau. Cet ion est appelé ion hydronium. Nous modifierons donc la notation de la définition du pH pour tenir compte de ce phénomène :
\[ \Large pH = - log([H_3O^+])\]
|
L'eau, une molécule vraiment particulière
 |
|
Cette structure moléculaire nous amène aussi à dire que la molécule d'eau est à la fois un acide (libérant H+) et comme une base (captant H+). C'est ce que l'on appelle un amphotère (ou ampholyte). Il est donc possible que l'eau réagisse sur elle même, c'est l'autoprotolyse :
\[ \Large H_2O + H_2O \rightleftarrows H_3O^+ + OH^-\]
La contante d'équilibre de cette réaction est particulière, on l'appelle le Kw. Sa valeur est de 10-14 ce qui amène pour l'eau pure une concentration en H+ et en OH- = 10-7. Soit un pH de 7.
\[ \Large K = [H_3O^+] . [OH^-]=10^{-14}\]
\[ \Large [H_3O^+] = [OH^-]= \sqrt{10^{-14}}= 10^{-7}\]
|
Il en va de même lorsqu'un acide est mis en solution, soit il s'agit d'un électrolyte fort, totalement dissocié et on écrira :
\[ \Large HCl \longrightarrow H^+ + Cl^-\]
\[ \Large H_2O + H^+ \longrightarrow H_3O^+\]
Soit c'est un électrolyte faible et il nous faudra considérer directement la réaction avec l'eau :
\[ \Large HNO_2 + H_2O \rightleftarrows H_3O^+ + NO_2^-\]
Et les sels dans tout cela ?
Le sel se dissocie ou s'ionise dans l'eau (en fonction de son caractère ionophore ou ionogène). Il forme donc des cations et des anions qui peuvent (ou pas) avoir un caractère acide ou basique. Nous allons devoir ajouter quelques notions importantes avant de pouvoir déterminer quel seront les propriétés d'un sel.
 |
Mesure de l'acidité, le pH
|
Le pH est donc la mesure (chiffrée) de l'acidité. Pour une solution donnée, sa valeur va dépendre :
-
de la nature du corps (acide ou base) mais aussi (électrolyte fort ou faible)
-
de la concentration du corps
Cette valeur permet de classer les solutions selon leur acidité sur une échelle appelée échelle de pH :
| |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| pH |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
| |
ACIDE |
NEUTRE |
BASIQUE |
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| [H+] |
1 |
10-1 |
10-2 |
10-3 |
10-4 |
10-5 |
10-6 |
10-7 |
10-8 |
10-9 |
10-10 |
10-11 |
10-12 |
10-13 |
10-14 |
| Exemple |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Il nous faut donc apprendre à déterminer si le corps est de nature acide ou de nature basique. Mais également, si il est totalement dissocié ou pas.
Les électrolytes forts
Par définition des électrolytes forts, ils sont totalement dissociés. La quantité en ions hydronium en solution est donc stoechimétrique avec la quantité d'électrolyte introduits dans la solution (pour autant que ce soit des acides ou des bases).
Pour les reconnaître, il faut savoir que :
- Les sels sont des électrolytes forts,
- Les acides dont le pKa est inférieur au pKa de H3O+ (-1,74) sont des électrolytes forts.
- Les bases dont le pKa est supérieur au pKa de OH- (15,74) sont des électrolytes forts.
Pour ces composés, lorsque l'on écrit une équation de dissociation, on utilisera une flèche unique. Cela signifie que la réaction est complète et donc que toutes les molécules sont transformées en ions. Il n'existe plus que des ions en solution.
Exemple pour un acide
\[ \Large \begin{array}{|c|c|} \hline &HCl &\longrightarrow & H^+&+&Cl^-\\\hline \hline n_i &1&&0&&0 \\\hline \hline n_r &-1&&+1&&+1 \\\hline \hline n_f &0&&1&&1 \\\hline \end{array} \] \[ \Large pH = - log([H_3O^+]) = - log(1)=0 \]
On en déduit donc une formule de pH pour les acides forts assez concentrés (concentration supérieure à 10-5M) :
\[ \Large \color{red}{ pH = - log(C_A)} \]
|
Exemple pour une base
\[ \Large \begin{array}{|c|c|} \hline &NaOH &\longrightarrow & Na^+&+&OH^-\\\hline \hline n_i &1&&0&&0 \\\hline \hline n_r &-1&&+1&&+1 \\\hline \hline n_f &0&&1&&1 \\\hline \end{array} \]
\[ \Large [H_3O^+]=\frac{10^{-14}}{[OH^-]}=\frac{10^{-14}}{1}=10^{-14} M \] \[ \Large pH = - log([H_3O^+]) = - log(10^{-14})=14 \]
On en déduit donc une formule de pH pour les bases fortes assez concentrées (concentration supérieure à 10-5M) :
\[ \Large \color{red}{ pH = 14 + log(C_B)} \]
|
Les électrolytes faibles
Dans le cas des électrolytes faibles, ils sont partiellement dissociés. Cela implique donc que la réaction de dissociation est une réaction équilibrée. Son avancement sera donc fonction d'une constante d'équilibre Ka (constante d'acidité) pour les acides et Kb (constante de basicité) pour les bases.
Tous les électrolytes qui ne répondent pas aux conditions pour être électrolyte fort, sont faibles. Dans ce cas, nous utiliserons une double flèche dans l'équation de dissociation pour montrer qu'il y a un équilibre entre la molécule dissociée et ses ions ... La molécule et ses ions existent tous en solution.
Exemple pour un acide
\[ \Large \begin{array}{|c|c|} \hline &HNO_2&+&H_2O &\rightleftarrows & H_3O^+&+&NO_2^-\\\hline \hline n_i &1&&55,56&&0&&0 \\\hline \hline n_r &-x&&-x&&+x&&+x \\\hline \hline n_f &1-x&&55,56-x&&x&&x \\\hline \end{array} \] \[\Large K_a=\frac{[H_3O^+][NO_2^-]}{[HNO_2]}=\frac{x^2}{1-x}\]
L'eau n'intervient pas dans l'expression de la constante car c'est le solvant !
En connaissant Ka, nous pouvons déterminer x et donc la concentration en H3O+. Il est possible de calculer le pH :
\[ \Large pH = - log([H_3O^+]) \]
Pour simplifier les calculs, il est possible de se référer à une formule de pH pour les acides faibles :
\[ \Large \color{red}{ pH = \frac{1}{2}( pKa - log(C_A))} \]
Le pKa est lié au Ka de la même façon que le pH est lié à la [H3O+]
\[ \Large \color{red}{ p}K_a = \color{red}{- log}(K_a) \]
|
Exemple pour une base
\[ \Large \begin{array}{|c|c|} \hline &NH_3&+&H_2O &\rightleftarrows & OH^-&+&NH_4^+\\\hline \hline n_i &1&&55,56&&0&&0 \\\hline \hline n_r &-x&&-x&&+x&&+x \\\hline \hline n_f &1-x&&55,56-x&&x&&x \\\hline \end{array} \] \[\Large K_b=\frac{[OH^-][NH_4^+]}{[NH_3]}=\frac{x^2}{1-x}\]
L'eau n'intervient pas dans l'expression de la constante car c'est le solvant !
En connaissant Kb, nous pouvons déterminer x et donc la concentration en OH- puis en H3O+.
\[ \Large [H_3O^+] = \frac {10^{-14}}{[OH^-]} \]
Il est possible de calculer le pH :
\[ \Large pH = - log([H_3O^+]) \]
Pour simplifier les calculs, il est possible de se référer à une formule de pH pour les bases faibles :
\[ \Large \color{red}{ pH = 7 - \frac{1}{2} pKa + log(C_B)} \]
Le Ka est lié au Kb de la même façon que la [OH-] est liée à la [H3O+]. Ce qui donne pour les pKa et pKb, la relation :
\[ \Large pK_a=14-pK_b \]
|
Que deviennent les acides et les bases lorsqu'ils ont réagi ?
 |
|
\[\Large HCl \longrightarrow H^++Cl^-\]
\[\Large HNO_2+H_2O \rightleftarrows H_3O^++NO_2^-\]
Dans ces deux exemples-ci, nous remarquons que la dissociation des acides mène à une entité négative (Cl- ou NO2-). Cette entité possédant des électrons, pourrait éventuellement capter un H+, il s'agit donc d'une base ! Les acides génère des bases en réagissant que l'on appelle BASE CONJUGUEE
\[\Large \begin{array}{|c|c|} \hline Acide& & Base\\\hline \hline Fort &\longrightarrow& Nulle\\\hline \hline Faible &\rightleftarrows& Faible\\\hline \end{array}\]
La force de la base résultante dépend de la force de l'acide. En effet, si l'acide est fort, donc totalement dissocié, la réaction inverse est impossible, l'entité négative est une base de force nulle. Si cette réaction est équilibrée, la réaction inverse est possible, il s'agit d'une base faible.
Cette logique est vraie aussi pour les bases :
\[\Large \begin{array}{|c|c|} \hline Base& & Acide\\\hline \hline Forte &\longrightarrow& Nul\\\hline \hline Faible &\rightleftarrows& Faible\\\hline \end{array}\]
L'acide et sa base conjuguée sont appelés couple acide-base (ex: HNO2/NO2-)
|
Calculer le pH dans la pratique
Dans la pratique, nous pouvons trouver une des qualtre solution dont nous avons parlé : acide fort, base forte, acide faible ou base faible. Pour savoir si c'est un acide ou une base, nous pouvons utiliser les propriétés des éléments chimiques :
- un hydroxyde métallique est une base
- les dérivés non métalliques (HXO et HX) sont des acides
Pour connaître leur force, on doit se référer à une table de pKa. Si il n'existe pas de pKa pour un acide ou une base dans la table, il n'y a pas d'équilibre de dissociation, le composé est donc fort. Dans la pratique, on peut retenir quelques acides et bases forts :
- acides forts : HCl, HBr, HI, HNO3, H2SO4 et HClO4
- bases fortes ; hydroxydes alcalins, alcalino-terreux et terreux
Ceux qui ne sont pas forts étant faibles ...
A côté de ces solutions, nous pouvons rencontrer des mélanges d'acides, des mélanges de base, des mélanges d'acide et de base ou encore des entités chimiques qui sont à la fois des acides et des bases (des amphotères, comme l'eau).
Mélange d'acide OU de base ... que le plus fort gagne ... souvent !
Lorsque l'on mélange deux électrolytes de même type acide ou base, nous ne considérons que l'électrolyte fort, pour autant que sa concentration soit suffisante (En réalité que la quantité d"ions H+ qu'il génère est bien plus importante que celle de l'électrolyte faible).
Quelques exemples :
- Un mélange d'HCl 0,3M et de HF 0,1M
- Un mélange de HF 0,3M et d'HCl 0,0001M
- Une solution de HCl 10-8M
Le premier sera clairement considéré comme un acide fort (HCl) car il génère bien plus d'ions H3O+, le pH sera donc :
\[ \Large pH = - log([H_3O^+]) = - log(0,3) =0,52 \]
Les deux autres solutions nécessitent d'analyser les quantités d'ions hydronium générées par chaque électrolyte
| 1 litre HF 0,3M et d'HCl 0,0001M |
1 litre d'HCl 10-8M |
|
\[ \Large \begin{array}{|c|c|} \hline &HF&+&H_2O &\rightleftarrows & H_3O^+&+&F^-\\\hline \hline n_i &0,3&&55,56&&0,0001 (HCl)&&0 \\\hline \hline n_r &-x&&-x&&+x&&+x \\\hline \hline n_f &0,3-x&&55,56-x&&0,0001+x&&x \\\hline \end{array} \] \[\Large K_a=\frac{[H_3O^+][F^-]}{[HF]}=\frac{x.(0,0001+x)}{0,3-x}=10^{-3,2}\]
Le calcul nous donne X=0,014, soit une [H3O+]=0,0141 et donc un pH de 1,85.
Le calcul sans l'HCl nous aurait donné : \[\Large K_a=\frac{[H_3O^+][F^-]}{[HF]}=\frac{x^2}{0,3-x}=10^{-3,2}\] , donnant X=0,014, soit une [H3O+]=0,013 et donc un pH de 1,88.
L'ajout de HCl modifiant la seconde décimale du pH, elle ne peut pas être considérée comme insignifiante.
|
\[ \Large \begin{array}{|c|c|} \hline &HCl &\longrightarrow & H^+&+&Cl^-\\\hline \hline n_i &10^{-8}&&10^{-7} (H_2O)&&0 \\\hline \hline n_r &-10^{-8}&&+10^{-8}&&+10^{-8} \\\hline \hline n_f &0&&1,1.10^{-7}&&10^{-8} \\\hline \end{array} \] \[ \Large pH = - log([H_3O^+]) = - log(1,1.10^{-7})=6,96 \]
Sans l(intervention de l'eau (qui produit 10x plus d'ions hydronium que la solution de HCl), le pH aurait été de 8, ce qui est impossible puisqu'une solution d'acide ne peut avoir un pH basique !
\[ \Large pH = - log([H_3O^+]) = - log(.10^{-8})=8 \]
|
Mélange d'acide ET de base, d'abord une réaction sauf si ils sont faibles et conjugués !
Lorsque l'on mélange un acide et une base, il a souvent réaction entre eux puisque l'acide cherche à donner des protons et la base à en capter. La seule raison pour laquelle un acide et une base ne réagirait pas ensemble est qu'ils apartiennent au même couple acide-base (ils sont dans ce cas conjugués).
Les réactions de neutralisation (entre un acide et une base) génèrent des sels. Lorsque cette réaction de neutralisation est réalisée dans le cadre du dosage de la quantité (d'acide ou de base), on parle alors de titrage.
Il faut donc, avant toute chose, écrire l'équation de la réaction et réaliser un tableau de bilan matière afin de déterminer les quantités finales de chacunes des substances. Différents cas sont possibles :
-
La neutralisation partielle d'un électrolyte fort (acide ou base). Comme il reste de l'électrolyte fort, la formule à utiliser sera celle liée à une solution de cet électrolyte.
-
La neutralisation complète d'un électrolyte (fort ou faible) qui mènera à un sel. Ce cas sera abordé avec les sels.
-
La neutralisation partielle d'un électrolyte faible qui mènera à un mélange d'acide et de base conjuguée que nous allons détailler directement.
Mélange d'acide et de base conjuguée
Détaillons donc le dernier cas, celui d'un mélange d'acide et de base conjugué. Ce mélange peut être réalisé en mélangeant dès le départ un acide et une base ou comme résultat d'une neutralisation partielle d'un électrlyte faible (acide ou base). Quelque soit la nature de l'électrolyte, la détermination du pH se réaliser de la même façon. Prenons l'exemple d'une neutralisation partielle, nous devons d'abord réaliser une stoechiométrie :
\[ \Large \begin{array}{|c|c|} \hline &Na_2CO_3 &+& HCl &\longrightarrow & NaHCO_3&+&NaCl\\\hline \hline Données &V=10,00mL=0,01L&&V=11,266 mL=0,011266L&&& \\&C=1,02M&&C=0,079M\\\hline \hline n_i &n=C.V=1,02.0,01&&n=C.V=0,079.0,011266&&0&&0 \\&n=1,02.10^{-2}&&n=8,9.10^{-4}\\\hline \hline n_r &\color{red}{-8,9.10^{-4}}&&\color{red}{-8,9.10^{-4}}&&\color{red}{+8,9.10^{-4}}&&\color{red}{+8,9.10^{-4}} \\\hline\hline n_f &9,31.10^{-3}&&0&&8,9.10^{-4}&&8,9.10^{-4} \\\hline \end{array}\]
On neutralise ici partiellement un sel (Na2CO3) ayant des propriétés basiques par un acide fort. La partie intéressante du sel est l'ion CO3--, la base faible se transformant en son acide conjugué (HCO3-). A la fin de la neutralisation, il nous reste de la base, on a formé l'acide conjugué et un autre sel (NaCl) qui lui, n'a aucune activité acide-base puisqu'il est formé de l'acide (de force nulle) correspondant à une base forte (Na+) et d'une base (de force nulle) correspondant à un acide fort (Cl-).
Comme la réaction a mélangé différentes solutions, il faut recalculer les concentrations de chaque ion.
| HCO3- |
CO3-- |
\[ C_{HCO_3^-}= \frac{n_{HCO_3^-}}{V_{Total}} = \frac{9,31.10^{-3}}{0,01+0,011266} = 0,44M\] |
\[ C_{CO_3^{--}}= \frac{n_{CO_3^{--}}}{V_{Total}} = \frac{8,9.10^{-4}}{0,01+0,011266} = 0,042M\] |
Nous entrons alors les concentrations finales dans la formule de pH consacrée à ces mélanges d'acides et de base conjugués en mélange :
\[ \Large pH = pK_a + log( \frac{C_b}{C_a})= pK_a + log( \frac{[CO_3^{--}]}{[HCO_3^-]}) = 10,33+log( \frac{0,44}{0,042})=10^{-3,67}=11,35\]
Les amphotères (ou ampholytes), les mélanges équimolaires d'acides et de bases faibles ... même traitement !
Un amphotère est une molécule qui possède à la fois un caractère acide et basique. Ces fonctions sont systématiquement des fonctions faibles. Comme elles sont présentes sur la même molécule, elles sont en même quantité. Les sels acides (hydrogénosels) sont tous des amphotères, sauf les hydrogénosulfates.
D'autres molécules, telles que NH4F génère en solution un mélange équimolaire
- en acide faible (NH4+)
- en base faible (F-)
Que ce soit pour un amphotère ou pour un mélange équimolaire d'acide faible et de base faible, le pH est indépendant de la concentration et se détermine par une formule qui n'est rien d'autre qu'une moyenne des deux pKa :
\[ \Large pH = \frac{pK_{a1}+pK_{a2}}{2} \]
 |
Des électrolytes forts particuliers, les sels ...
Les sels résultent de réactions entre des acides et des bases. Nous l'avons vu, pendant ces réactions dites de neutralisation, les acides se transforment en leur bases conjuguées et inversément pour les bases. La force de ces électrolytes conjugués dépendent de la force de l'électrolyte de départ.
Afin de pouvoir déterminer le pH d'une solution saline, il faut analyser d'oû provient le sel. De cette analyse moléculaire, nous saurons quelle formule (parmi celles déjà vues) il nous faudra ppliquer.
NaCl 0,1M
\[ HCl + NaOH \longrightarrow NaCl \]
Dans le cas de NaCl, Ce sel est produitpar la réaction entre l'acide chlorhydrique et l'hydroxyde de sodium. Les deux étant des électrolytes forts, ils produisent des électrolytes de force nulle. Le pH de la solution sera donc de 7. La solution est neutre puisqu'elle ne contient ni base, ni acide.
NaHSO4 0,1M
\[ H_2SO_4 + NaOH \longrightarrow NaHSO_4 +H_2O\]
Dans le cas de l'hydrogénosulfate de sodium, cette molécule est produite par des électrolytes forts, les électrolytes conjugués n'ont donc pas de force. PAr contre, l'ion HSO4- qui n'est donc pas une base conjuguée à l'acide sulfurique possède encore un hydrogène acide (Il s'agissait d'un hydrogénosel, issu donc d'une réaction de neutralisation incomplète), il s'agit sonc d'un acide faible, nous traiterons donc cette solution en temps que telle.
\[ \Large pH = \frac{1}{2} . (pK_{a_{HSO4^-}}-log(C_A))= \frac{1}{2}.(1,9-log(0,1) = 1,45 \]
KNO2 0,1M
\[ HNO_2 + KOH \longrightarrow KNO_2 +H_2O\]
Dans ce cas, le nitrite de potassium provient de la réaction d'un acide faible avec une base forte. Seul l'acide faible génèrera un électrolyte avec une activité acide-base. Associé à l'acide faible, nous aurons une base faible ... l'ion nitrite. Le calcul du pH sera donc :
\[ \Large pH = 7+ \frac{1}{2} . (pK_{a_{HNO_2}}+log(C_B))= 7+ \frac{1}{2}.(3,35-log(0,1) = 9,17 \]
NH4Cl 0,1M
\[ NH_3 + HCl \longrightarrow NH_4Cl\]
Ici, le chlorure d'ammonium provient de la réaction entre l'ammoniac et l'acide chlorhydrique. L'acide chlorhydrique étant un acide fort, sa base conjuguée ne participera pas à la modification du pH. Il nous restera donc l'ion ammonium qui est l'acide conjugué à l'ammoniac. Le pH sera donc celui d'un acide faible :
\[ \Large pH = \frac{1}{2} . (pK_{a_{NH_4^+}}-log(C_A))= \frac{1}{2}.(9,25-log(0,1) = 5,12 \]
LiHSO3 0,1M
\[ H_2SO_3 + LiOH \longrightarrow LiHSO_3 +H_2O\]
Dans la formation de ce sel, nous retrouvons une bae forte (LiOH) et un acide faible partiellement neutralisé. Cette neutralisation partielle amène un ion hydrogénosulfite qui est la base conjuguée de l'acide sulfureux mais qui possède encore un hydrogène acide, c'est donc aussi un acide faible. Nous sommes face à un amphotère, son pH sera donc la moyenne des pKa des deux couples :
\[ \Large pH = \frac{pKa_1+ pKa_2}{2} = \frac{1,81+ 6,99}{2}=4,4\]
|
 |
L'équilibre de l'acidité, un élément important pour le vivant
|
Après avoir décrit toutes les facettes de ces réactions acide-base, il nous reste à prendre conscience que leur importance, biologique par exemple ....
Les organismes vivants sont prévus pour fonctionner avec certains paramètres. Dans ces paramètres, le pH joue un rôle important. Prenons le cas d'un fluide corporel important, le sang ... De nombreuses molécules sont transportées par le sang mais il est malgré tout important qu'il garde son pH.
Pour arriver à maintenir le pH, le corps utilise une propriété de certains mélanges que l'on appelle mélanges tampons. Ces mélanges ont la caractéristique de très peu changer de pH losqu'on leur ajoute une millimole d'acide ou de base forte par litre.
L'exemple le plus fréquent : le mélange d'acide faible et de base conjuguée
Dans la gamme de pH corporel, cet équilibre utilise des mélanges d'acides faibles et de base faibles conugués. Prenons l'exemple d'un mélange fort utilisé, le tampon carbonate (H2CO3/HCO3-). Le principe est de garantir toujours plus ou moins le même rapport entre l'acide faible et la base faible, on peut comprendre cela avec la formule :
\[ \Large pH = pK_a + log( \frac{C_b}{C_a})\]
On remarque que si le rapport entre les concentrations (Cb/Ca) reste plus ou moins constant, le pH ne variera pas beaucoup. Prenons l'exemple du sang dont le pH est de 7,2, nou pouvons déterminer que ce rapport est de :
\[ \Large pH = pK_a + log( \frac{C_b}{C_a})= 6,33 + log( \frac{C_b}{C_a})=7,2\]
\[ \Large \frac{C_b}{C_a} = 10^{7,2-6,33}=7,41\]
Il y a donc pour maintenir ce pH presque huit fois plus de base que d'acide. Un peu d'acide ou de base ne changera pas fondamentalement ce rapport si les quantités sont assez grandes. Ceci garanti une stabilité importante du pH. Afin que ce mélange puisse jouer son rôle de tampon le plus longtemps possible, il est important de se situer à un pH près du pKa (plus ou moins une unité). Ici, pour un pH à 7,2, on a un couple dont le pKa est de 6,33.
Ceci s'explique par les courbes de pH lors de la neutralisation des électrolytes faibles. Le graphique suivant montre l'évolution du pH lors de la neutralisation d'un acide faible et d'une base faible. La neutralisation complète est réalisée à 10 mL. A 5 millilitres, on a neutralisé la moitié de l'électrolyte, le rapport Cb/Ca vaut alors 1 et son logaritme vaut alors 0, à ce moment pH= pKa.
Nous remarquons qu'autour des 5 mL, le pH varie très peu, c'est cet effet tampon ....
Les acides et bases fortes, de bons tampons aux pH extrêmes
Quand on regarde les courbes de neutralisation pour les acides et bases fortes, nous voyons qu'il existe aussi une zone ou le pH ne varie pas beaucoup :
- Entre pH=0 et pH=2 pour les acides forts
- Entre pH=12 et p=14 pour les bases fortes
A ces pH, ces électrolytes peuvent être utilisés comme mélange tampon
 |
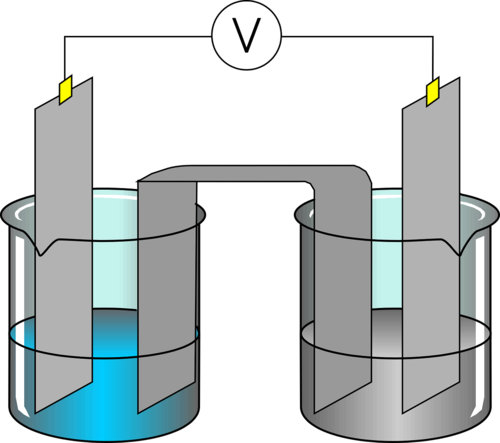
Les mesures de l'acidité et de la composition en électrolytes |
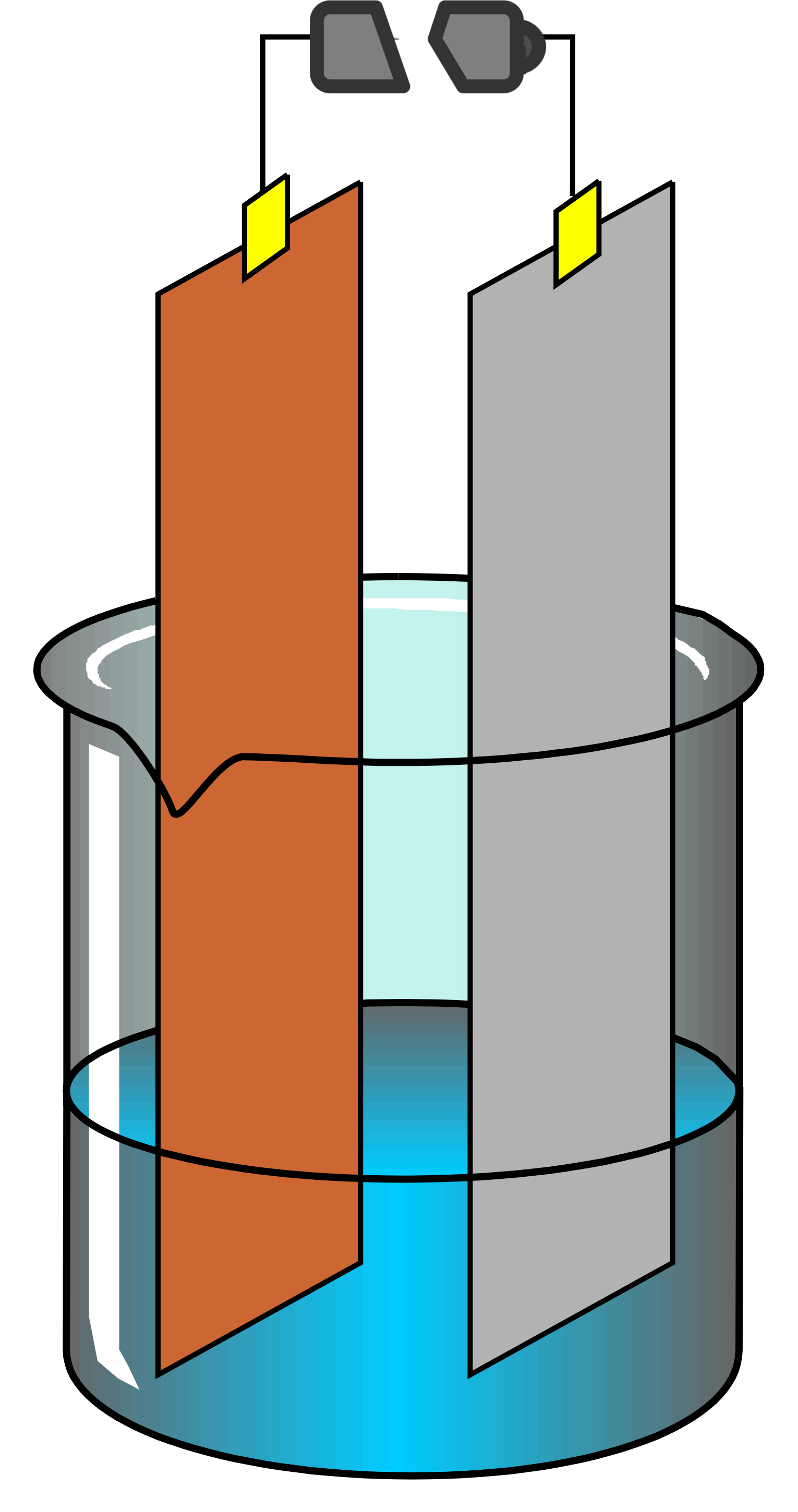
Voici en une photo interactive le matériel dont nous avons besoin pour réaliser un titrage.
Le principe du titrage est de réaliser une réaction chimique en mesurant précisément les volumes de chaque réactifs. La concentration d'un des deux réactifs est connue précisément, c'est le titrant. Le tableau de bilan de matière nous permettra de déterminer le nombre de moles de l'autre réactif : le titré et sonc sa concentration.
\[ \Large \begin{array}{|c|c|} \hline &HCl &+& NaOH&\longrightarrow & NaCl & H_2O\\\hline \hline Données &V=10,0 mL=0,010 L&&C=1M&&& \\&C=?&&V=11,33 mL = 0,01133 L\\\hline \hline n_i &&&n=C.V=1.0,01133&&0&0 \\&&&n=0,01133 moles\\\hline \hline n_r &&&-0,01133&&+0,01133&+0,01133 \\\hline \hline n_f &0&&0&&0,01133&0,01133 \\\hline \end{array} \]
A l'aide de ce tableau, nous déterminons donc que 0,01133 moles de HCl ont réagi. Nous pouvons donc déterminer la concentration de la solution de HCl :
\[ \Large C = \frac{n}{V}=\frac{0,01133 moles}{0,010 L}= 1,13 \frac{moles}{L}\]
Il est possible de suivre le titrage à l'aide de deux graphiques différents :
- Le suivi pHmétrique, réalisé en mesurant le pH lors de chaque ajout de titrant (courbe noire, axe Y de gauche)
- Le suivi en bilan de matière (courbes bleues, axe Y de droite)
|
Les réactions de précipitation concernent des substances dites peu solubles. Lors de leur synthèse, les molécules se regroupent pour former un solide au fond du milieu réactionnel.
A nouveau, il sagit ici d'un état d'équilibre, la dissolution de ces substances est régie par une constante d'équilibre ...
|
|
Prenons un exemple pour expliquer ce phénomène :
\[ \Large CaCl_2 + Na_2SO_4 \longrightarrow CaSO_4 + 2 \;NaCl\]
Dans cette réaction, nous faisons réagir deux sels. Jusqu'ici, nous n'avions jamais parlé d'une telle réaction. Il s'agit d'une réaction d'échange d'ions entre deux sels solubles. Le moteur de cette réaction est que le sulfate de calcium est un sel peu soluble. Il va donc précipiter et un équilibre va s'installer entre le solide et les ions calcium et sulfate en solution.
\[ \Large CaSO_4 \rightleftarrows Ca^{++} +SO_4^{--}\]
Comme il s'agit d'un équilibre, on doit donc écrire une constante d'équilibre afin de décrire l'équilibre mathématiquement. Cette constante d'&quilibre est un peu particulière car le réactif est solide et ne s'y écrit donc pas :
\[ \Large K_S= [Ca^{++}].[SO_4^{--}]\]
Cette constante dont les valeurs sont à trouver dans la table des constantes de solubilité, peut être reliée à la solubilité.
La solubilité (notée S) est, par définition, la quantité (en moles ou en grammes) d'une substance que l'on peut dissoudre dans un litre de solution. Exprimée en moles, il s'agit donc de la quantité de moles de sulfate de calcium par litres qui s'est transformée en ions. Elle représente donc, ici, la quantité en ions formés, vu le tableau de bilan de matière suivant : on place la quantité exacte de sulfate de calcium correspondant à la solubilité, qui se dissous donc totalement.
\[ \Large \begin{array}{|c|c|} \hline &CaSO_4 &\longrightarrow & Ca^{++}&+&SO_4^{--}\\\hline \hline n_i &S&&0&&0 \\\hline \hline n_r &-S&&+S&&+S \\\hline \hline n_f &0&&S&&S \\\hline \end{array} \]
On peut donc relier la constante à la solubilité et en connaissant la valeur de la constante, déterminer la valeur de la solubilité exprimée en moles/L.
\[ \Large K_S= [Ca^{++}].[SO_4^{--}]= S . S = S^2\]
\[ \Large S= \sqrt{K_S}= \sqrt{4,93 . 10^{-5}}= 7.10^{-3} \frac{moles}{L}\]
 |
Si il y a des coefficients stoechimétriques, il doivent être en exposant des concentrations et donc des solubilités ....
Si, dans un exercice, il existe déjà un des ions, il faut en tenir compte dans le tableau. La concentration des deux ions ne sera donc pas identique ...
Lorsque des ions H3O+ ou OH- sont mis en jeu dans l'équation, il y a un lien avec le pH !
|
Exemple d'exercice avec des coefficients stoechiométriques
Déterminer la solubilité du chromate d'argent.
\[ \Large \begin{array}{|c|c|} \hline &Ag_2CrO_4 &\longrightarrow & 2 Ag_+&+&CrO_4^{--}\\\hline \hline n_i &S&&0&&0 \\\hline \hline n_r &-S&&+2S&&+S \\\hline \hline n_f &0&&2S&&S \\\hline \end{array} \]
\[ \Large K_S= [Ag^+]^2.[CrO_4^{--}]= (2S)^2 . S = 4S^3\]
\[ \Large S= \sqrt[3]{\frac{K_S}{4}}= \sqrt[3]{\frac{1,12.10^{-12} }{4}}= 5,29.10^{-7} \frac{moles}{L}\]
Exemple d'exercice avec une quantité d'ions déjà présente
Déterminer la solubilité du sulfate de calcium dans une solution de sulfate de sodium 0,05 M
\[ \Large \begin{array}{|c|c|} \hline &CaSO_4 &\longrightarrow & Ca^{++}&+&SO_4^{--}\\\hline \hline n_i &S&&0&&0,05 \\\hline \hline n_r &-S&&+S&&+S \\\hline \hline n_f &0&&S&&0,05+S \\\hline \end{array} \]
\[ \Large K_S= [Ca^{++}].[SO_4^{--}]= S . (0,05 + S)= 0,05S + S^2 = 4,93 . 10^{-5}\]
\[ \Large S^2 + 0,05S - 4,93 . 10^{-5} = 0 \]
La détermination des racines de cette équation du second degré nous donne X1= -0,05 et X2 = 9,67 . 10-4. Comme l'inconnue (la solubilité) doit être une valeur positive, c'est une quantité, la solubilité vaut 9,67 . 10-4 mole/L, en diminution par rapport aux 7 . 10-3 moles/L calculé dans le premier exercice lorsqu'il n'y avait pas d'excès en ions sulfate. C'est normal, avec la présence d'une quantité d'ions sulfate, on arrive plus vite à la valeur de la constante, il faut dissoudre moins de sulfate de calcium pour que le produit des concentrations soit égal à cette constante.
Exemple d'exercice pH dépendant
Déterminer la solubilité de l'hydroxyde de calcium à pH=12.
\[ \Large \begin{array}{|c|c|} \hline &Ca(OH)_2 &\longrightarrow &Ca^{++}&+&2 OH^-\\\hline \hline n_i &S&&0&&10^{-1} \\\hline \hline n_r &-S&&+S&&+2S \\\hline \hline n_f &0&&S&&10^{-2}+2S \\\hline \end{array} \]
La quantité d'ions OH- présent au départ est calculé à partir de la valeur du pH :
\[ \Large pH= -log( [H_3O^+])\]
\[ \Large [H_3O^+] = 10^{-pH} = 10^{-12}\]
\[ \Large [H_3O^+]. [OH^-] = 10^{-14} \]
\[ \Large [OH^-] = \frac{10^{-14}}{[H_3O^+]} = \frac{10^{-14}}{10^{-12}} = 10^{-2} \]
On peut alors calculer à nouveau la solubilité à l'aide de la constante de solubilité.
\[ \Large K_S= [Ca^{++}].[OH^-]^2= S . (10^{-2}+2S)^2= 10^{-4}S + 4.S^3 = 5,02 . 10^{-6}\]
\[ \Large 4.S^3 + 10^{-4}S - 5,06 . 10^{-6} = 0 \]
Les racines de ce polynôme du troisième degré sont : X1= -0,017 et X2= 0,0085. La solubilit est donc de 0,0085 moles /L !