|
Certaines molécules en se cassant forment des ions ... polyatomiques, c'est la dissociation |
|
|
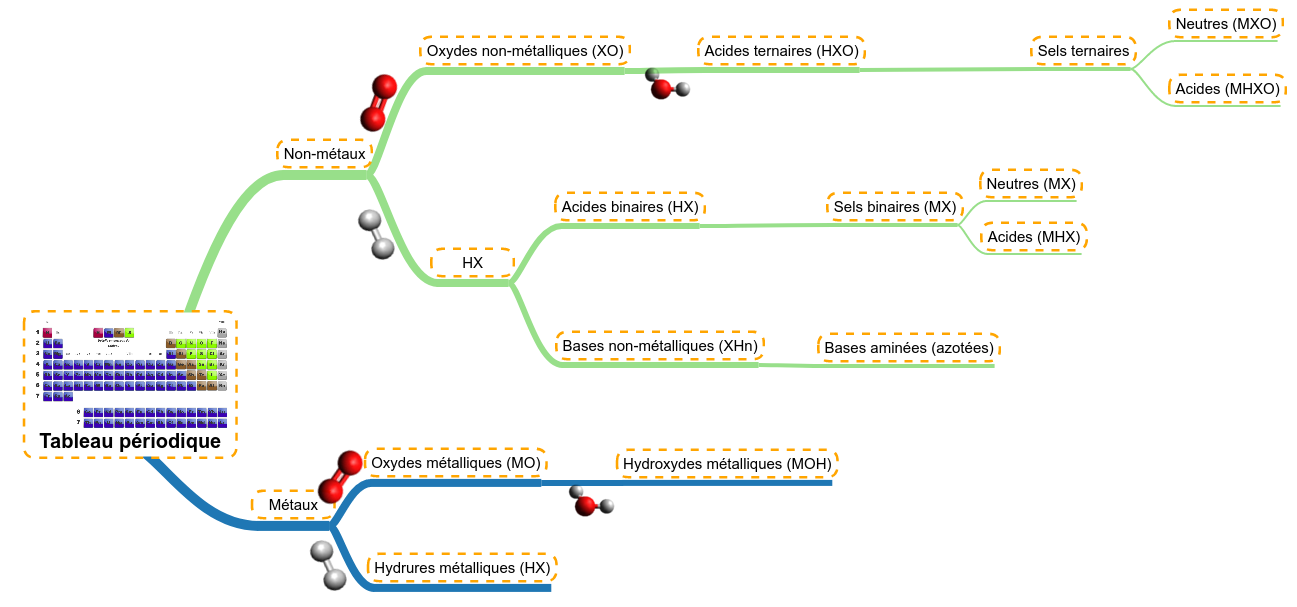
Nous avons vu que les ions sont des particules chargées qui peuvent être monoatomiques (un atome qui gagne ou qui perd des électrons). Ces ions peuvent aussi être polyatomiques (composés de plusieurs atomes), il s'agit alors de parties de molécules. En effet, certaines molécules ont des liaisons plus fragiles qui peuvent se rompre. Souvent, la rupture d'un telle liaison est la conséquence d'une différence d'électronégativité assez importante entre deux atomes. La rupture se réalise alors de façon hétérolytique : les deux électrons de la liaison se déplacent sur un atome. Cela génère deux fragments chargés (ions) :
Exemple : H2SO4 → 2 H+ + SO4--
|
 |
Dans un premier temps, le plus facile est de pouvoir retenir les ions polyatomiques les plus courants ainsi que leur charge. Cela sert à construire facilement les structures moléculaires et à écrire les produits de réaction. Voici les ions classés par élément :