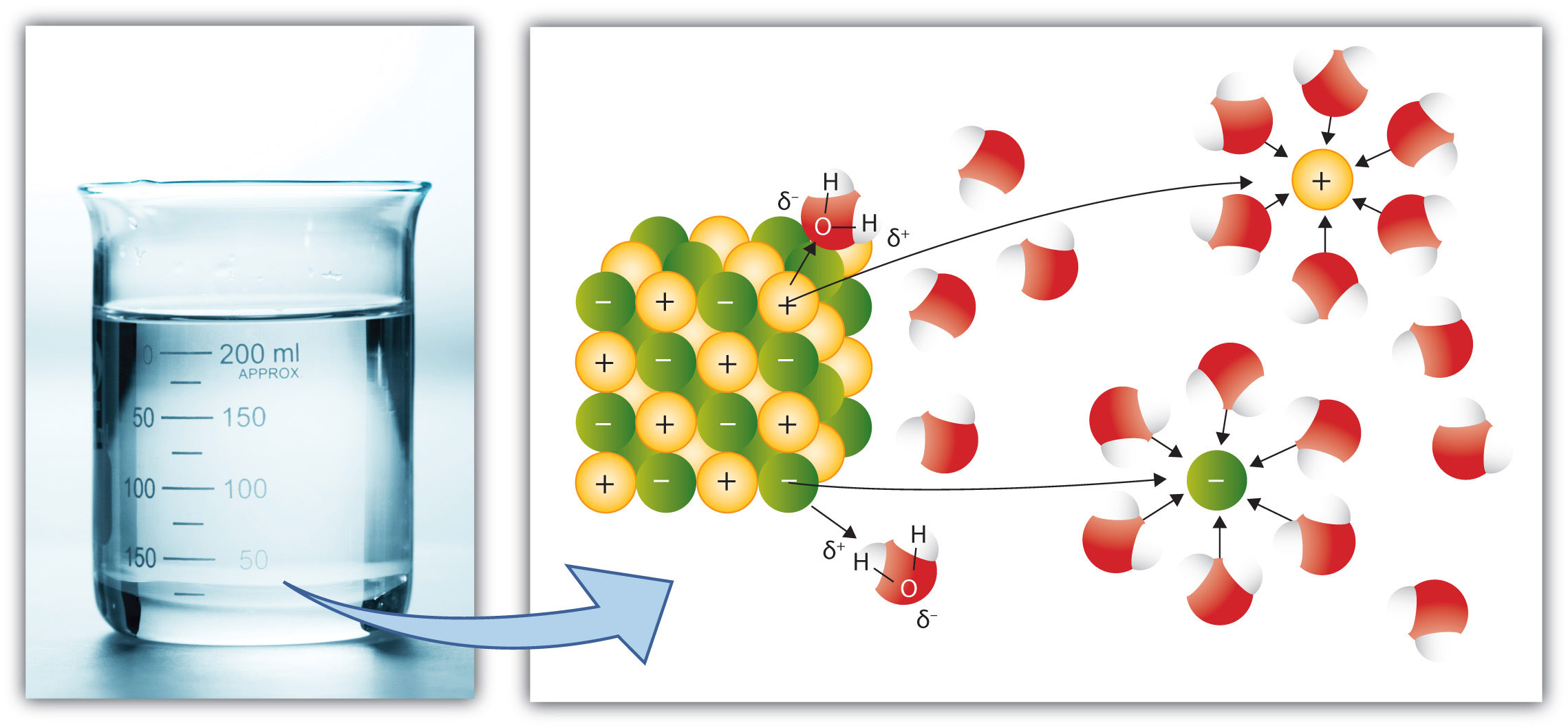
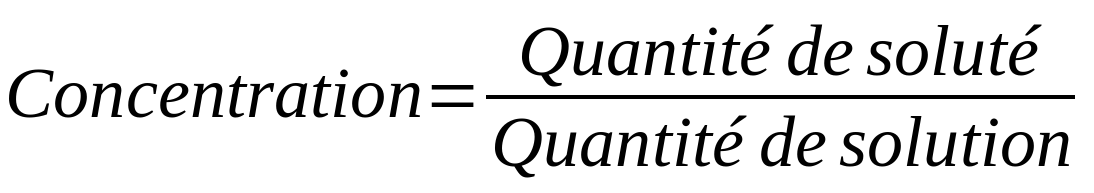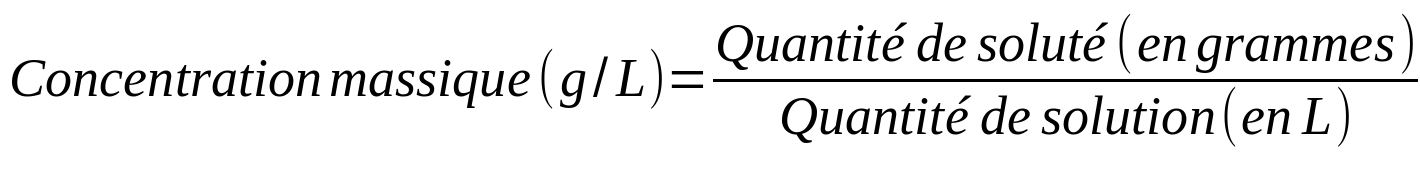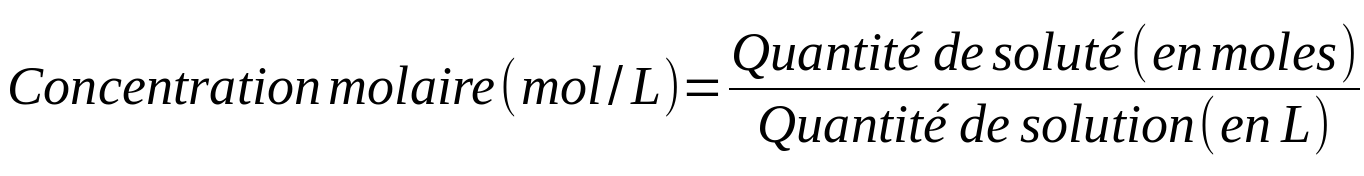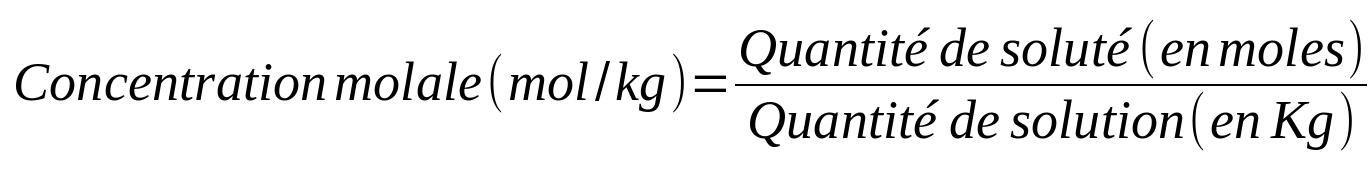|
Nous avons décrit les états de la matière. Il est possible de passer de l'un a l'autre en changeant des paramètres. C'est l'étude microscopique qui va nous aider à comprendre comment ces paramètres vont influencer ces changements d'état.
Ci-contre, une vidéo montrant l'effet Mpemba. Cet effet met en avant que l'eau chaude peu geler plus rapidement que de l'eau froide dans certaines conditions. |
 |
Les paramètres influençant les changements d'état
|
||||
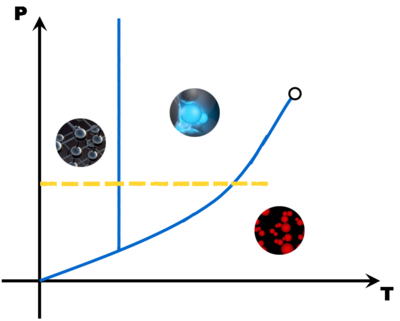
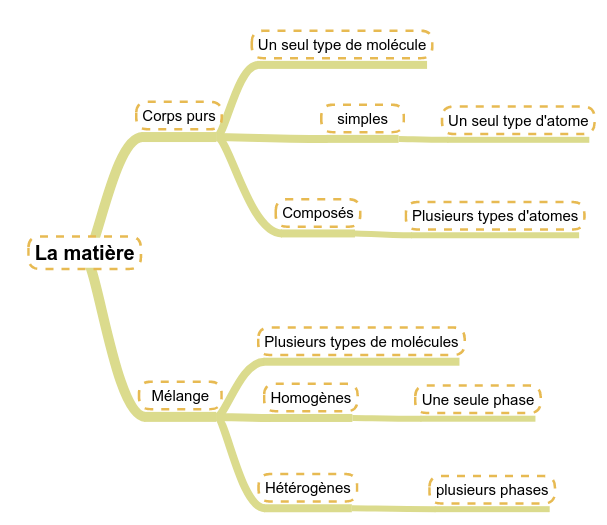
Si l'on reprend les représentations moléculaires des différents états, on remarque que ce qui les différencie est :
- le mouvement des particules
-
l'espace entre les particules
Pour augmenter le mouvement des particules, il faut leur donner de l'énergie afin d'augmenter leur agitation. C'est possible à l'aide d'un apport en énergie thermique. Le paramètre mesurable sera LA TEMPERATURE. Une augmentation de température favorisera LA FUSION et LA VAPORISATION.
L'espace entre les molécules peut être favorisé par une variation de LA PRESSION. Une augmentation de la pression favorisera LA CONDENSATION et LA SOLIDIFICATION.
Il y a donc systématiquement des couples de valeurs de pression et de température pour lesquels un corps est solide, liquide ou gazeux. Certaines valeurs particulières amènent à des changements d'état (fusion, vaporisation, ...).
Avec tous ces couples pression - température, on peut construire un diagramme (appelé diagramme d'état) qui montre trois grandes zones, une pour chaque état de la matière. A la limite de deux zones, une droite ou une courbe matérialise l'équilibre entre deux états (le changement d'état).
 |
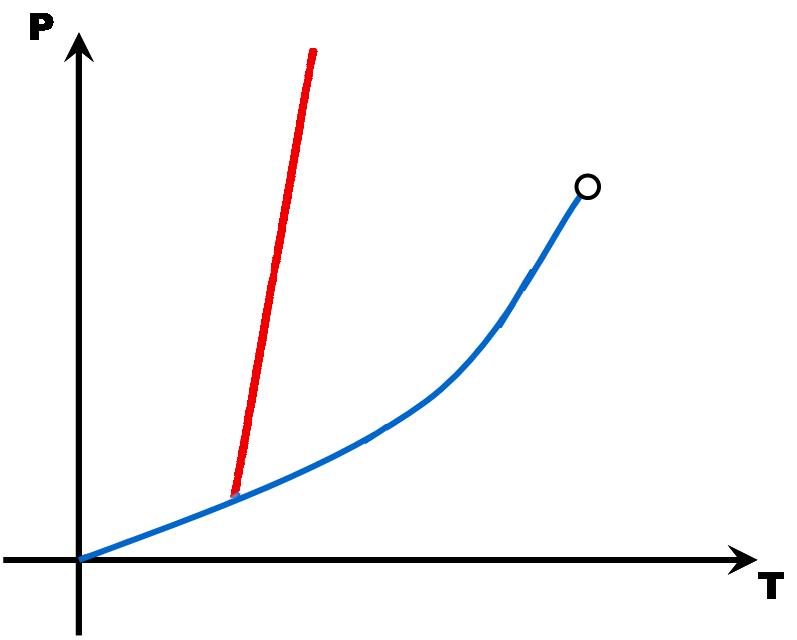
Avec quelques points (Point triple, point critique, point de fusion, point d'ébullition et éventuellement le point de sublimation), il est possible de tracer une esquisse du diagramme d'état d'une matière. Comme en math, il faut juste deux points par droite ou par courbe ... |
 |
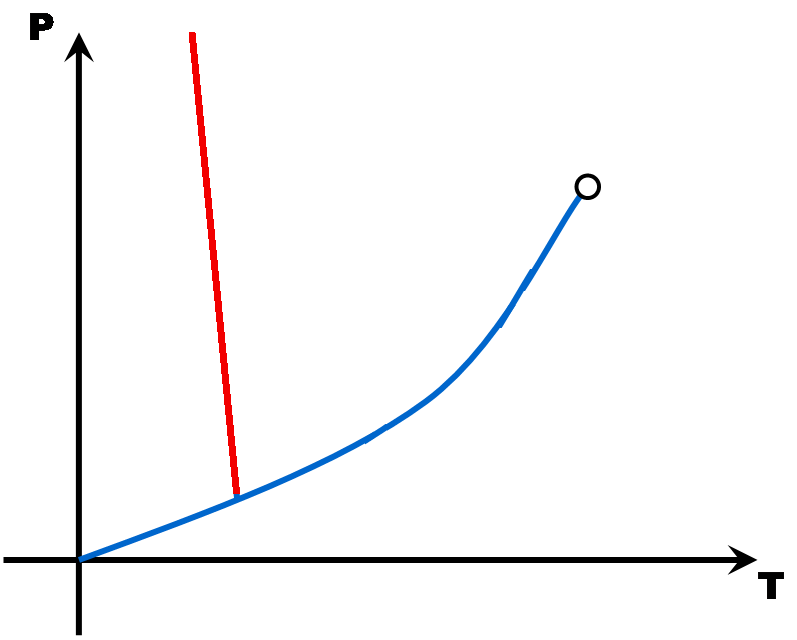
La pente de la droite de fusion (rouge) est toujours positive (droite penchée vers la droite) .. Sauf pour l'eau dont la pente de la droite de fusion est négative (droite penchée vers la gauche). 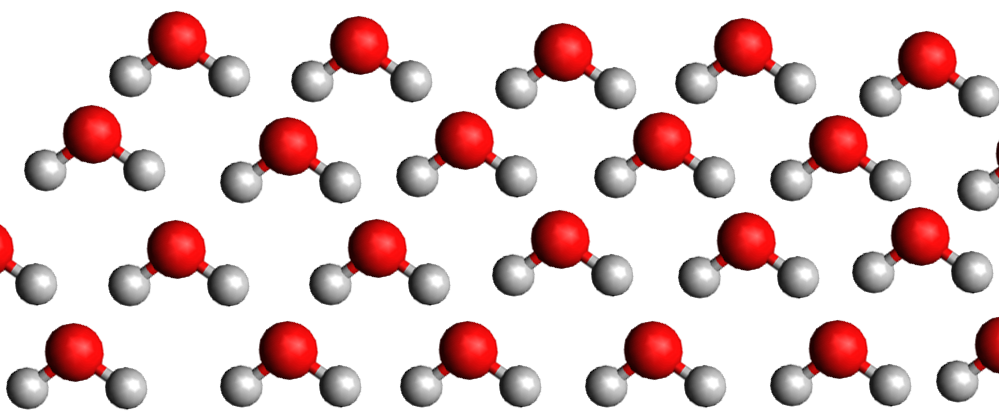
Eau liquide
Eau solide
|
|
||