|
Vu l'interdépendance des chapitres, les exercices et les outils de ludo apprentissage sont commun à la partie atome et la partie tableau périodique. |
Apprendre
Le tableau périodique contient l'ensemble des éléments existant. Ils y sont classés en périodes (lignes) et en familles (colonnes). Ce classement a été réalisé au fil du temps et initié par Mendeleïev sur base des propriétés physiques et chimiques des éléments. Les périodes permettent le classement par couche électroniques. Dans une meme période, de case en case, on ajoute à chaque fois un proton et donc un électron. Le point commun de tous les éléments d'une même période est qu'ils ont la même couche électronique externe caractérisée par le numéro qui se trouve au début de la période (le nombre quantique principal, n).
 |
Les familles | ||||
Dans une famille, les éléments ont des propriétés similaires. On découvre qu'il y a des familles "a" et des familles "b".
Les familles a sont celles qui sont le plus facile à appréhendre dans leurs propriétés électroniques. Il arrive souvent, qu'au début de l'apprentissage de la chimie, on demande de plier le tableau afin de ne voir que ces familles a.
 |
La famille Ia s'appelle les ALCALINS La famille IIa s'appelle les ALCALINO-TERREUX La famille IIIa s'appelle les TERREUX La famille IVa s'appele les CARBONIDES La famille Va s'appelle les AZOTIDES La famille VIa s'appelle les SULFURIDES La famille VIIa s'appelle les HALOGENES La dernière famille s'appelle les GAZ NOBLES ou GAZ INERTES |
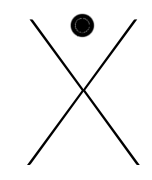
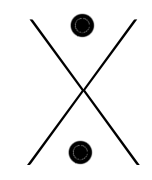
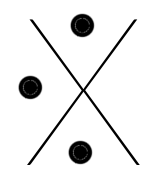
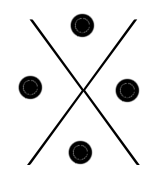
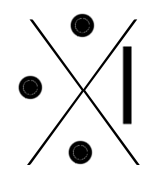
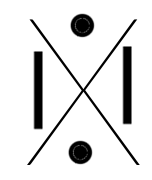
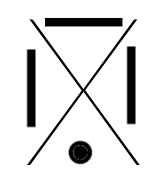
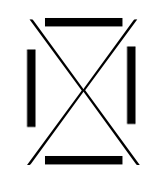
Chaque famille rassemble des éléments qui ont le même nombre d'électrons périphériques (même nombre d'électrons sur la dernière couche). Ainsi, à chaque famille, on associe une structure appelée "structure de Lewis".
C'est une convention qui permet de représenter visuellement la composition de la dernière couche d'un atome en utilisant :
- un point pour représenter un électron célibataire
- un trait pour représenter un doublet (deux électrons sur une même orbitale).
Voici les différentes structures de lewis, famille après famille :
| Ia | IIa | IIIa | IVa | Va | VIa | VIIa | VIIIa |
| ALCALINS | ALCALINO-TERREUX | TERREUX | CARBONIDES | AZOTIDES | SULFURIDES | HALOGENES | GAZ INERTES |
 |
 |
 |
 |
 |
 |
 |
 |
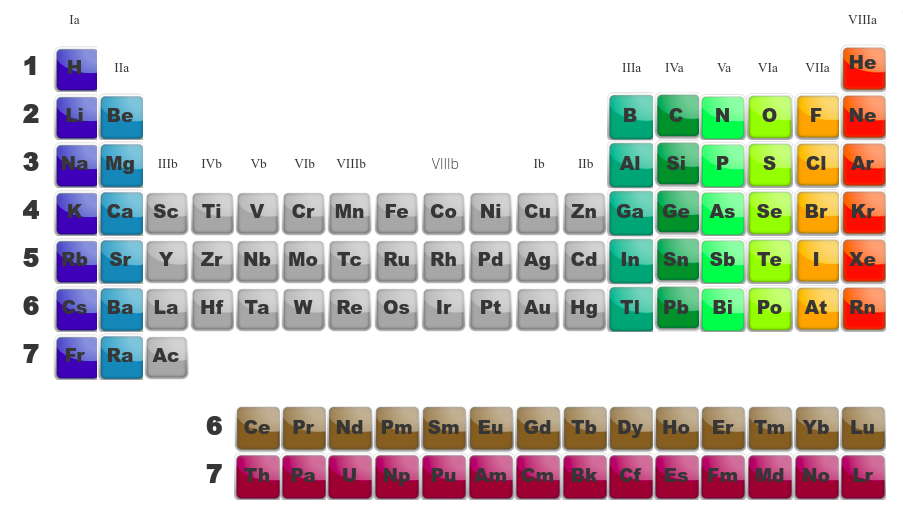
Les familles b sont appelées "métaux de transition". Ils ont des propriétés particulières.
 |
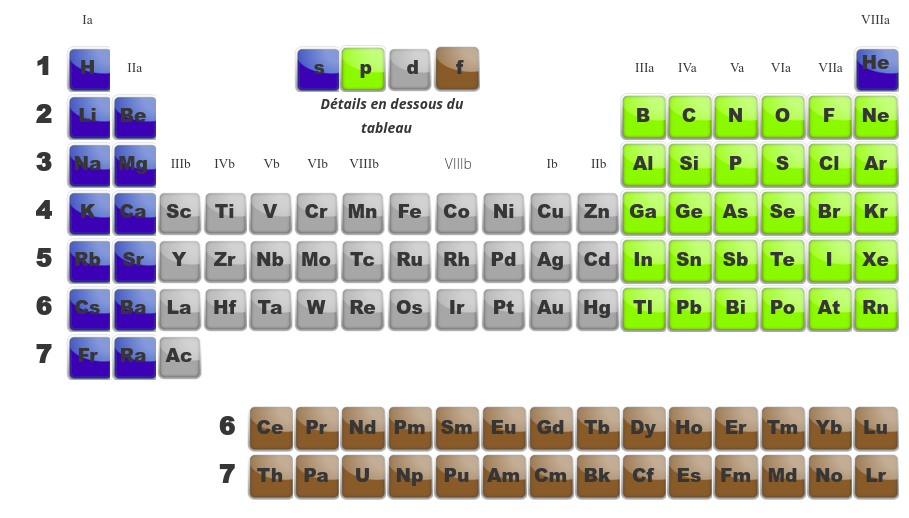 |
Quand on compare les tableau de gauche (montrant les différentes familles) avec celui de droite (montrant la dernière orbitale en cours de remplissage), on se rend compte de similitudes. Ainsi :
-
les deux premières familles (alcalins et alcalino-terreux) ont une orbitale du type s comme dernière orbitale. -
Les métaux de transition, eux, ont comme dernière orbitale, des orbitales de type d. -
Les terreux (famille IIIa), les carbonides (IVa), les azotides (Va), les sulfurides (VIa), les halogènes (VIIa) et les gaz inertes (VIIIa) remplissent des orbitales p. -
Finalement, les actinides et les lanthanides qui sont en dessous du tableau remplissent des orbitales f.
Le classement des éléments dans le tableau périodique est lié à leur composition en protons. Il est donc possible à partir de cette composition de retrouver la position d'un élément.
 |
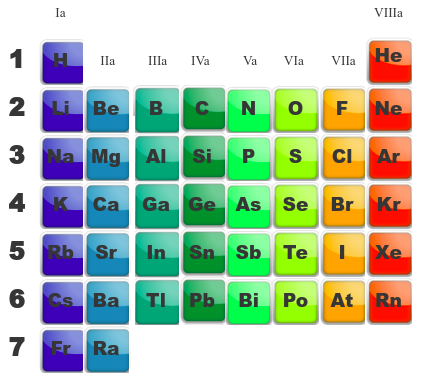
Les métaux, les non-métaux ... et les autres ! | ||||
On a l'habitude dans le tableau périodique de regrouper les éléments en trois groupes différents ; les métaux, les non-métaux et les métalloïdes. Ce regroupement provient du fait qu'ils ont certaines caractéristiques similaires.
On peut distinguer les métaux des non-métaux chimiquement ou physiquement. Voici un tableau qui reprend ce qui différencie généralement les propriétés des métaux et des non-métaux. On remarque qu'un non-métal est l'exact contraire d'un métal ...
|
|
|
|
||
|
|
|
 |
 |
|
|
 |
 |
||
|
 |
 |
||
|
|
|
|
||
|
|
Elevé |
 Faible Faible |
||
|
|
|
Faible |
Importante |
|
|
|
 |
 |
||
 |
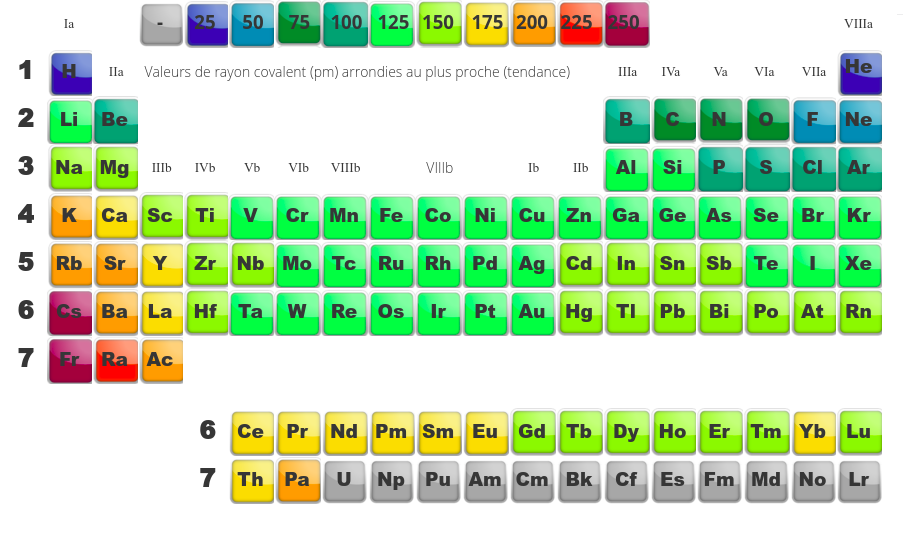
La taille des atomes, un paramètre révélateur
|
||||
Finalement, dans l'étude du tableau périodique, il nous reste à parler de la taille des atomes. En remplissant le tableau périodique case par case, nous pouvons remarquer que deux phénomènes se passent :
- Le noyau se peuple peu à peu en nucléons (protons et neutrons)
- Le nuage électronique se peuple en électrons (qui souhaitent se repousser)
Globalement, en ajoutant un proton à chaque case, on a tendance à rapprocher peu à peu les électrons du noyau puisque d'avantage de charges positives les attirent ... tant que l'on rempli une mêmecouche électronique. Dès que l'on entame une nouvelle couche électronique, ces nouveaux électrons, plus en périphérie ressentent moins le noyau. Cette dernière couche est donc plus ample, prend plus de place.
La conclusion est simple :
- Dans une période, la taille des atomes a tendance à diminuer car même si on ajoute des électrons (ce qui devrait amener une augmentation du volume du nuage électronique et donc de l'atome), l'augmentation assez importante de la charge du noyau contracte le nuage électronique.
- Dans une famille maintenant, les deux tendances vont dans le même sens puisque l'on augmente à la fois le nombre d'électrons et on augmente le nombre de couches électroniques, la taille de l'atome augmente.
Dans le diagramme de droite, on remarque bien que chaque fois que l'on change de période, on a une augmentation brusque de la taille des éléments (on passe d'élements avec un nuage électronique fort compacté en fin de période à des éléments auquels on ajoute subitement une nouvelle couche en début de période). Entre deux pics, on a une diminution régulière de la taille qui correspond à l'augmentation de la charge du noyau et à la contraction au fur et à mesure du nuage électronique au fil d'une période.
 |
Les autres informations du tableau périodique | ||||
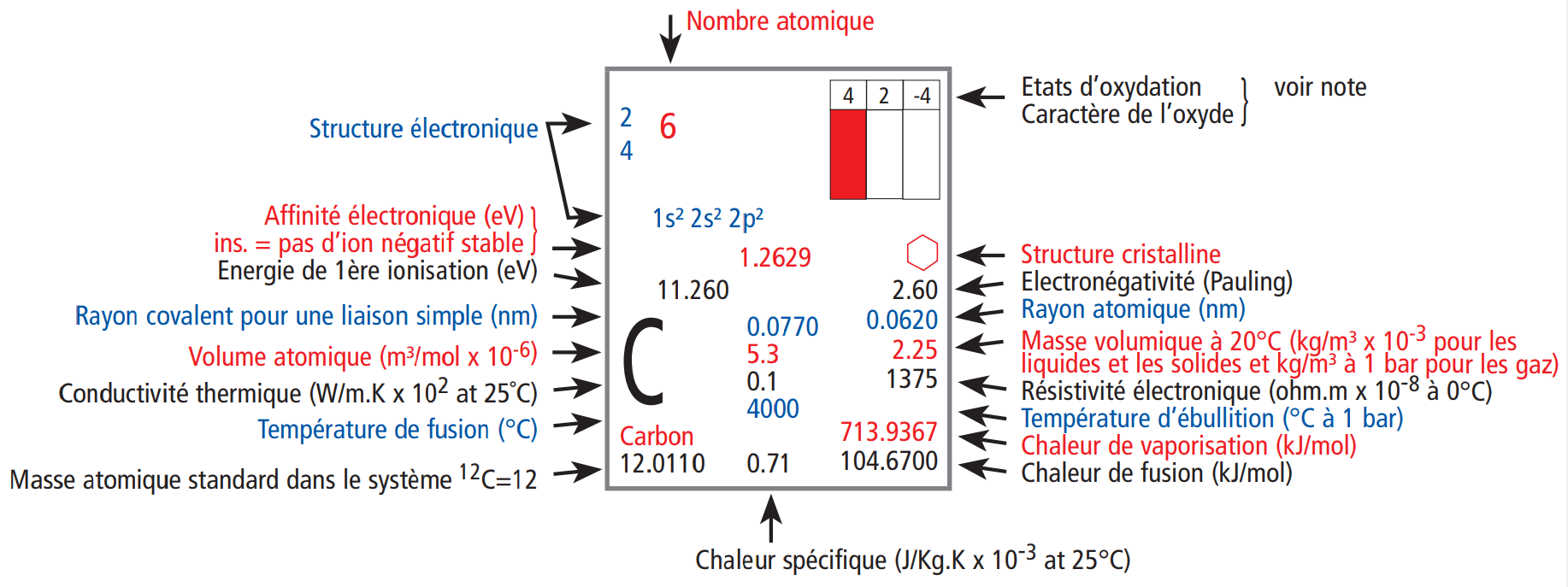
En fonction du tableau périodique, nous pouvons retrouver des informations plus ou moins nombreuses dans chaque case. Certains tableaux périodiques chercheront à être simples et compréhensibles pour tous, généralement ceux dédiés à l'enseignement secondaire ... et d'autres au contraire chercheront à être les plus complets possibles ... ceux dédiés à l'enseignement supérieur.
Nous avons choisi de vous montrer cette différence en prenant deux exemples : le tableau iss du site wikipédia et le bien connu provenant de la société UCB. On peut remarquer une grande différence en terme de nombre d'informations. Alors que celui de wikipédia se limite à présenter des informations essentielles liées à la structure de l'atome (comme nous l'avons fait ici), celui d'UCB reprend de nombreuses informations liées cette fois à la matière (chaleurs de changement d'état, ...) ou des valeurs atomiques plus pointues (énergie d"ionisation, ...).
 |
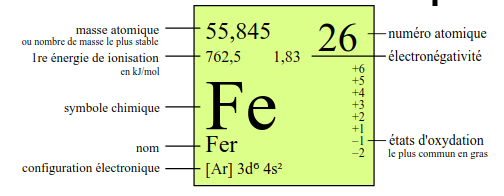 |
| Description des des cases du tableau périodique UCB | Description des des cases du tableau périodique WIKIPEDIA |
Dans tous les cas, les informations indispensables sur un tableau périodique sont :
- Le nom de l'élément
- Le symbole de l'élément
- Le nombre atomique
- La masse atomique relative
- La structure électronique de l'atome (soit selon Bohr {KLMNOP}, soit selon le modèle orbitalaire {1sX ...}
- L'électronégativité (dont nous allons parler rapidement)
Toutes les autes informations peuvent être utiles mais pas essentielles. On remarquera déjà que la structure élctronique peut être retrouvée facilement comme nous l'avons vu mais pour gagner du temps, il est toujours bon de pouvoir l'avoir sous la main.
|
{aridoc engine="google" width="750" height="1050"}images/Telechargements/Chimie/TPUCB-2A4.pdf{/aridoc}
Pour vos cours, nous vous conseillons d'imprimer et d'utiliser le tableau UCB. A l'origine, c'est un tableau périodique au format A3. Nous vous proposons une version que nous avons retravaillée afin d'imprimer le tableau sur deux feuilles A4 que vous pouvez alors assembler pour retrouver le tableau périodique A3.
|