Cours
La grande variabilité de ces molécules provient de la grande diversité des fonctions chimiques. Voici un aperçu des principales fonctions, dans un premier temps, l'important est de pouvoir les identifier à l'aide de la succession des atomes dans les groupements.
Les molécules uniquement composées de C et H
Les molécules organiques les plus simples, ne sont composées que d'atomes de carbone et d'atomes d'hydrogène. Elles font partie de la grande famille des hydrocarbures (hydro pour hydrogène et carbure pour carbone).
Dans les hydrocarbure, nous diffencierons les molécules uniquement composées de liaisons C-C simples, dites saturées (les alcanes) des hydrocarbures insaturés (alcènes et alcynes) qui comportent des liaisons doubles ou triples entre des atomes de carbone.
| Les alcanes, de formule brute CnH2n+2, sont très peu réactifs. Ils sont principalement utilisés comme solvants (white spirit, éther de pétrole) ou de combustibles (kérosène, essence, diesel, ...). |
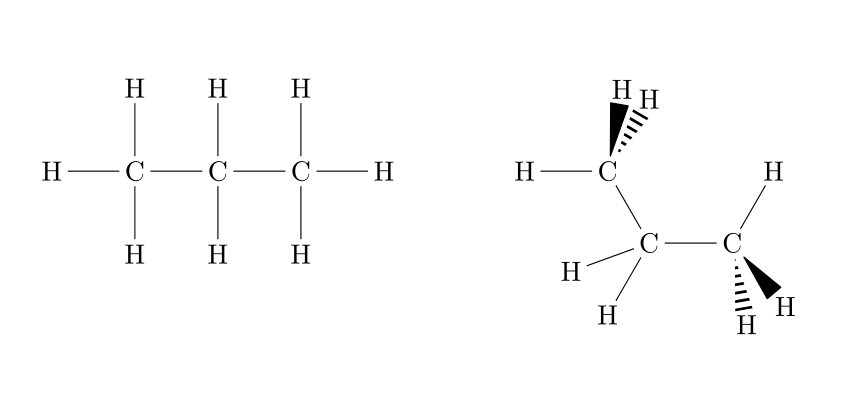 |
Les hydrocarbures insaturés, eux, sont bien plus réactifs et sont la porte ouverte à la fonctionnalisation des hydrocarbures.
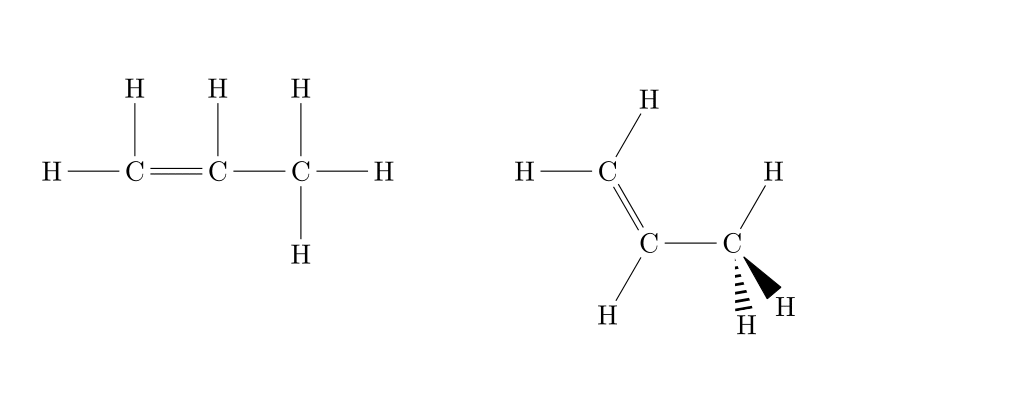 |
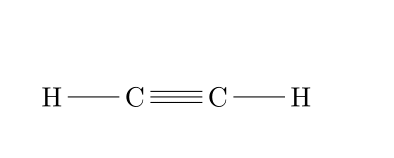 |
| Alcène |
Alcyne |
Comme les liaisons présentes dans ces molécules sont peu polarisées, tous ces hydrocarbures sont apolaires, ils interagissent par des forces de Van der Waals de type dipôle instantané- dipôle instantané. Leur point d'ébullition est relativement bas (ils sont fort volatiles) et ne se mélangent pas à l'eau (deux phases). Leur densité étant faible, ils surnagent sur l'eau.
Les molécules halogénées
Voici deux grands types différents de composés organiques contenant des halogènes :
| Type de liaison |
Fonction |
Exemple |
|
| C-X |
Dérivé halogéné |
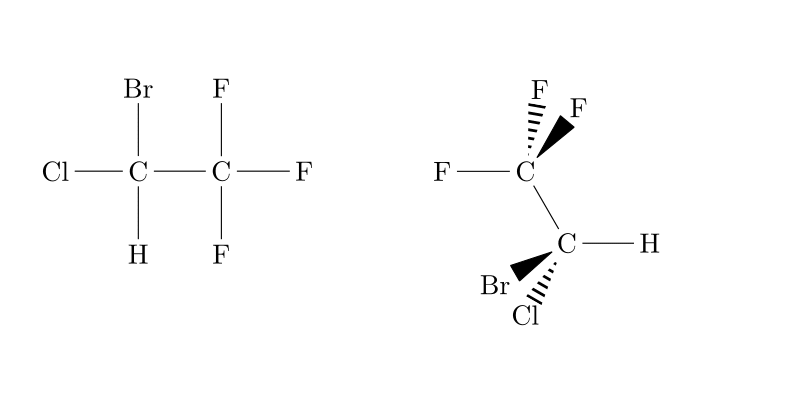 |
En fonction de l'halogène :
- F = Dérivé fluoré
- Cl = Dérivé chloré
- Br = Dérivé bromé
- I = Dérivé iodé
|
| C(=O)-X |
Halogénure d'acide |
|
D'autres types de composés
| Type de liaison |
Fonction |
exemple
|
| C-S-H |
Thiol |
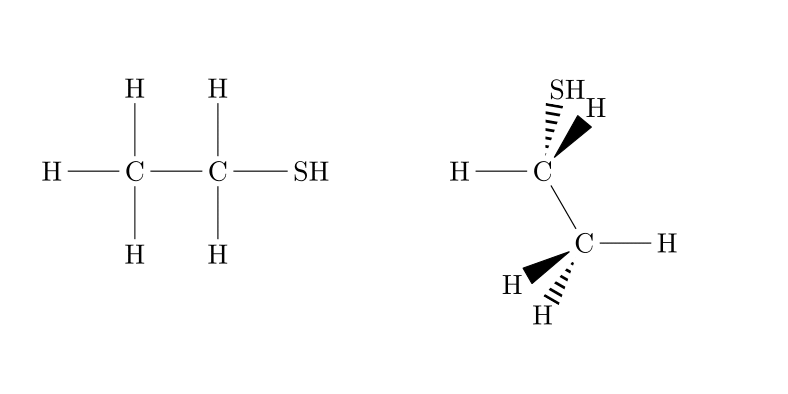 |
| |
|
|
Il est évidemment possible que les molécules organiques contiennent plusieurs fonctions identiques ou différentes
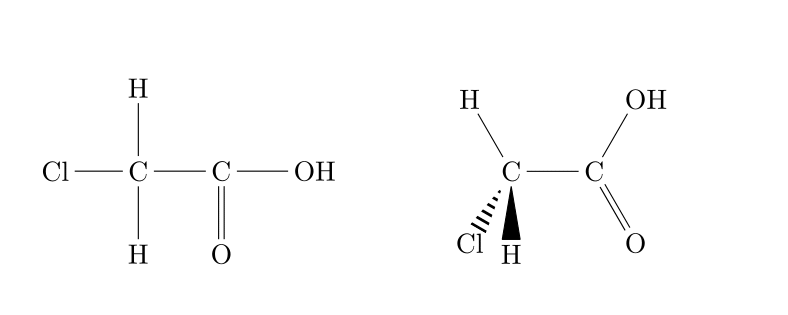 |
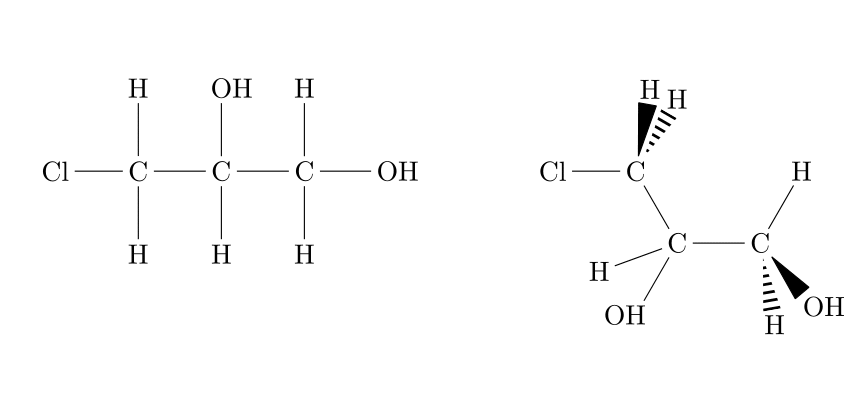 |
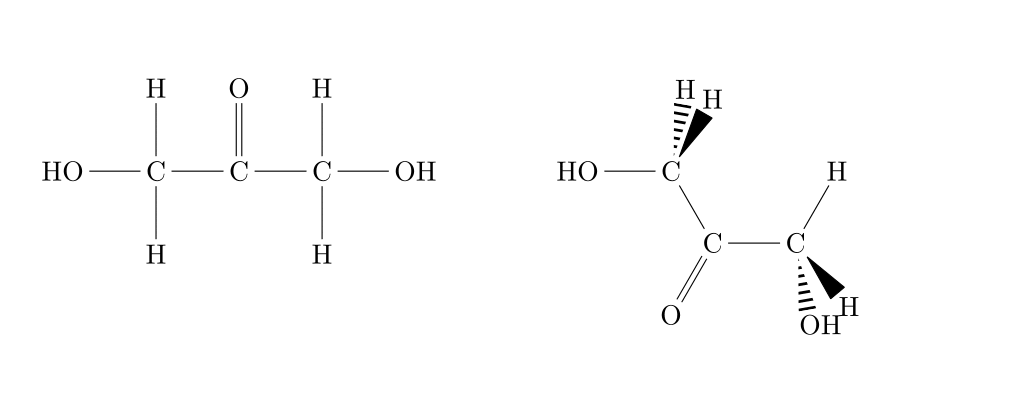 |
|
| Dérivé halogéné et acide carboxylique |
Dérivé halogéné et alcool (2x) |
Alcool (2X) et cétone |
|
 |
L'évolution des propriétés physiques et chimiques dépend
- d'abord du type de fonction (de sa polarité)
- ensuite de la structure de la molécule
Ainsi, pour deux molécules comportant deux fonctions différentes, la plus polaire sera :
- plus soluble dans l'eau
- aura un point d'ébullition plus important
Lorsque deux molécules possèdent la même fonction, la variation de propriétés sera due à :
- la taille de la chaine hydrocarbonée
- la forme de la chaine
- la position de la fonction dans la molécule
|
La richesse de ces molécules en terme de diversité, a obligé le chimiste à abandonner ou à enrichir les représentations que nous utilisions en chimie minérale.
La formule brute : pratiquement inutile
La formule brute d'un composé est la liste des éléments constitutifs (déterminée, par exemple, par analyse élémentaire). On mentionne la nature et le nombre d'atomes constituants la molécule sans apporter de renseignements sur leur mode d'enchaînements (par exemple Na2SO4, C4H10O) . Cette formule brute n'a que peu d'intérêt en chimie organique, elle ne permet pas de caractériser la molécule. Ici, nous aurons besoin de connaître la façon dont sont liés les atomes constitutifs les uns par rapport aux autres tant de petits changements d'organisation peuvent entrainer de grandes modifications de propriétés. De là résulte la nécessité des formules développées, destinées à expliciter cette disposition interne des atomes. Cette formule brute, souvent utilsée en chimie minérale, ne nous servira plus ici qu'à calculer la masse molaire d'une molécule !
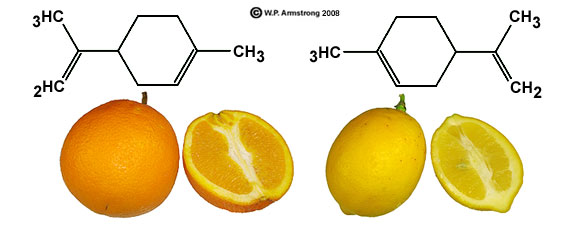 Voici un exemple concret d'une toute petite différence de structure :
Voici un exemple concret d'une toute petite différence de structure :
une molécule donne l'odeur d'orange, l'autre de citron. Toutes deux de formule brute C10H16
Représentation en deux dimensions (2D)
Formule développée plane
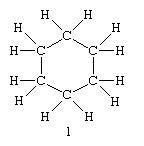
On appelle "formule plane" la projection plane, sur une feuille de papier, d'une molécule ayant un espace tridimensionnel. Une telle formule n'a pour objet que de montrer l'enchaînement des éléments constitutifs et n'a en aucun cas la prétention de représenter la géométrie réelle de cette molécule. Elle néglige des éléments importants comme l'arrangement spatial et l'aspect électronique. Dans les formules développées, la chaîne de carbone est présentée comme une droite. La règle à suivre pour construire des formules exactes, est de respecter la valence de chaque élément. Tétravalence pour le carbone, l'oxygène bivalent et l'hydrogène monovalent, etc ... On y voit absoluùents tous les atomes et toutes les liaisons entre eux.
Formule semi-développée plane
Les formules planes développées deviennent très encombrantes pour la manipulation de structures moléculaires de taille importante. Pour cette raison, on utilise des formules semi-développées qui représentent la molécule de manière simple et précise. Ainsi les liaisons entre atomes de carbone et d'hydrogène ne sont pas représentées et un enchaînement de n atomes de carbones peut être simplifié de la façon suivante : (CH2)n .
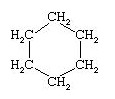
Formule simplifiée plane
La simplification peut encore être augmentée en se limitant au dessin des liaisons et hétéro atomes uniquement (autre que C et H). Dans cette représentation, on ne dessine plus ni les atomes de carbone, ni les atomes d'hydrogène fixé sur un atome de carbone. Une chaîne hydrocarbonée est représentée par une ligne brisée.
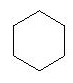
Représentation en trois dimensions (3D)
Formule développée
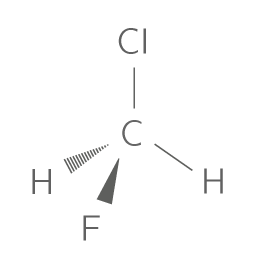
La formule développée consiste à écrire l'entièreté de la molécule en respectant les règles de géométrie des molécules. La représentation de Cram (1953) utilise les conventions résumées ci-dessous pour le dessin des liaisons.
La formule simplifiée "améliorée"
Sous le terme 'formule simplifiée', on trouve une structure qui est de loin la plus utilisée. Il s'agit de notre formule simplifiée à laquelle on a ajouté la géométrie globale de la molécule et développé en otation de Cram juste les atomes intéressants. Il s'agit du meilleur compromis entre toutes les structures.
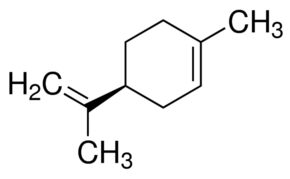







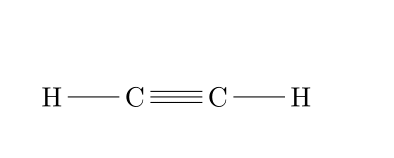
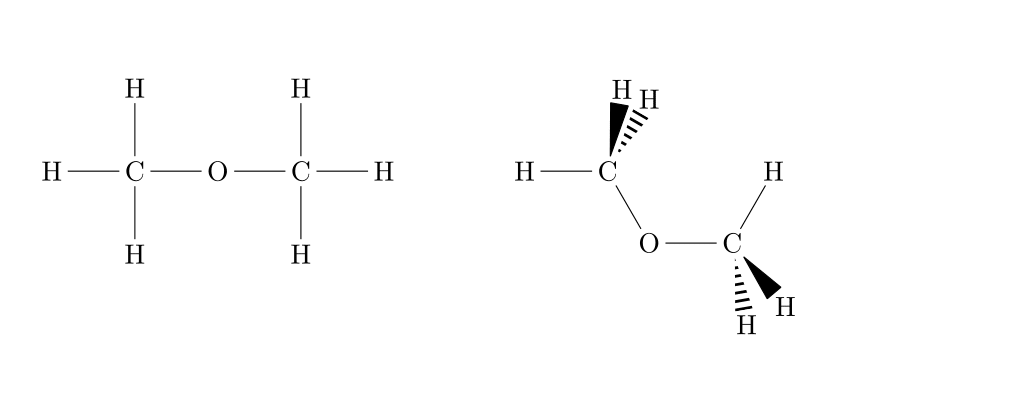
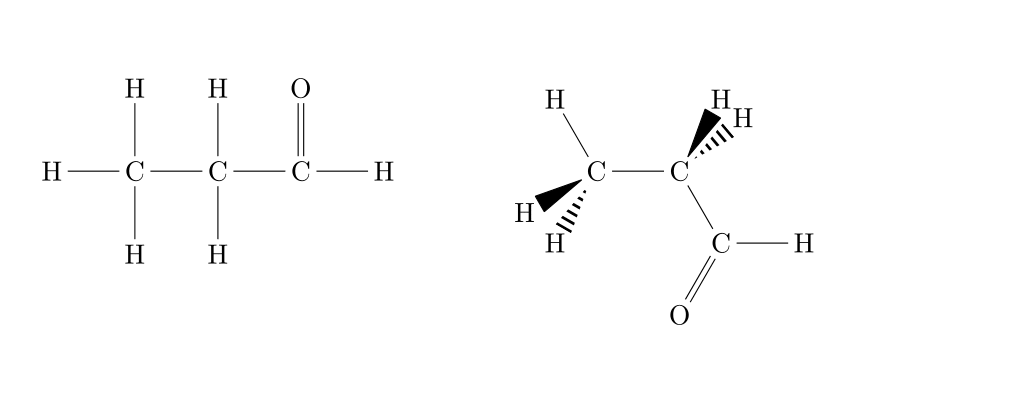
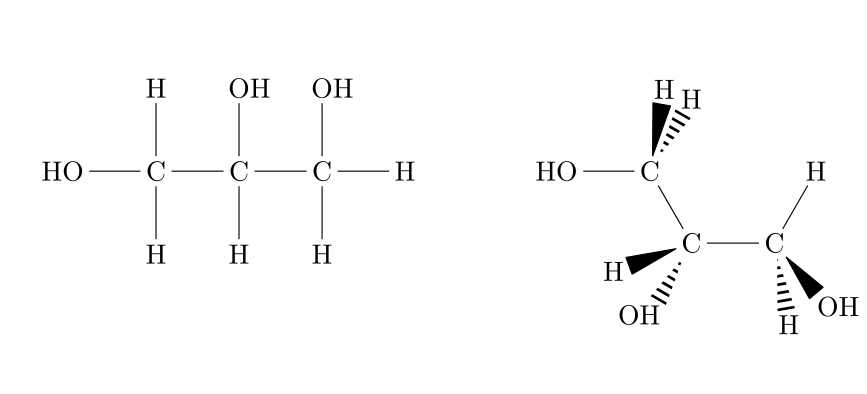
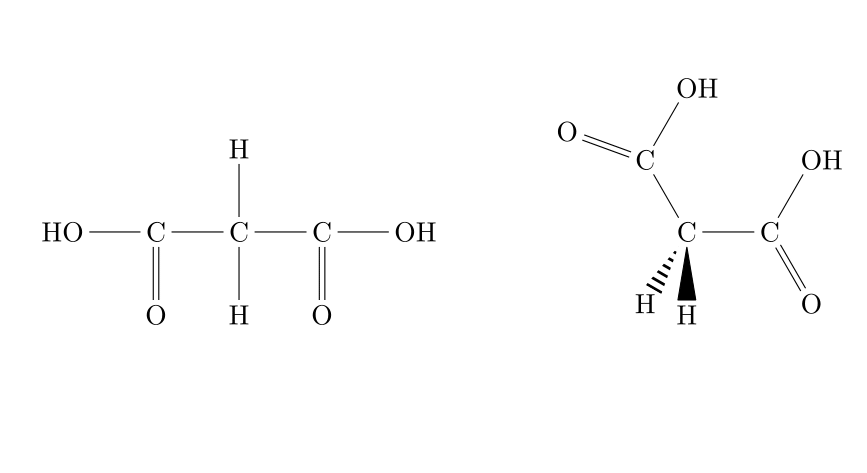
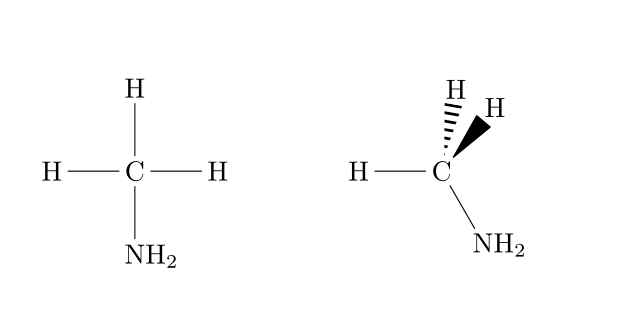
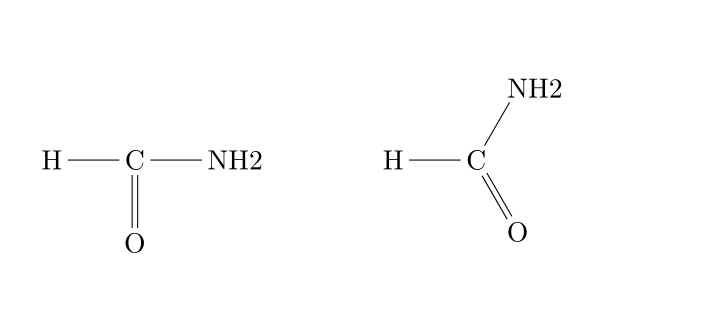
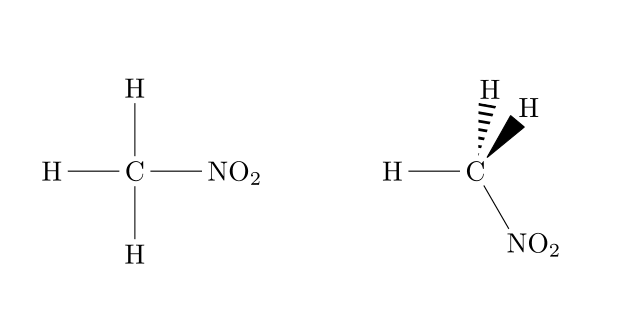


 Voici un exemple concret d'une toute petite différence de structure :
Voici un exemple concret d'une toute petite différence de structure :