Cours
|
Les réactions d'oxydation ou de réductions sont omniprésentes dans notre monde. Elles nous sont très utiles (feu, nettoyage, assainissement, protection des aliments) mais elles sont aussi fondamentales pour tout être vivant. La respiration, la photosynthèses mettent en jeu ce type de réactions. Il est donc très important de les comprendre ...
|
|
 |
Quelques définitions
|
Les réactions d'oxydo-réduction sont définies par un échange d'électrons un par un (et non plus de doublets) entre deux partenaires, un oxydant et un réducteur.
- L'oxydant capte les électrons
- Le réducteur donne des électrons
|
Nous pouvons facilement montrer ce transfert d'électrons par l'attaque des métaux par les acides. En effet, un grand nombre de métaux réagissent avec beaucoup d'acides, par exemple ici le zinc avec l'acide chlorhydrique :
\[ \Large Zn + 2\;HCl \rightarrow \; ZnCl_2 + H_2\]
Dans cet exemple, le zinc (élémentaire) n'a aucune charge. Après réaction avec l'acide, il y a eu formation d'un sel, le chlorure de zinc qui amène le zinc à porter une charge +2. Cette charge marque la perte de deux électrons, ce sera aussi l'étage d'oxydation du zinc dans ZnCl2.
|
|
L'association de ces deux réactions est appelée oxydo-réduction. Comme il y a échange d'électrons, il y aura une modification des étages d'oxydation de certains éléments. C'est une caractéristique qui permet facilement de déterminer que nous sommes devant une telle réaction.
Comme la réaction de réduction est l'inverse de l'oxydation, chaque réaction sera réversible, elles seront donc toutes équilibrées ... Par contre, associer une réaction d'oxydation et une réaction de réduction pourra permettre des réactions complètes, cela dépendra de leur force !
 |
Attention, deux définitions viennent parfois semer le trouble :
- La réaction d'oxydation qui est le fait pour un réactif de perdre des électrons est subie par les REDUCTEURS.
- La réaction de réduction qui est l'inverse de l'oxydaion (capter des électrons) est subie par les OXYDANTS.
Au final donc un oxydant se réduit (il passe donc d'une forme oxydée à une forme réduite) et un réducteur s'oxyde (il passe d'une forme réduite à une forme oxydée).
|
A nouveau, nous aurons des couples, appelés couples rédox auquels sera associée une valeur qui caractérisera la force du couple (oxydant ou réducteur fort ou faible). Cette valeur est appelée Potentiel standard (noté E°) et exprimé en Volts. Comme il s'agit de transfert d'électrons, nous ne serons pas étonnés de voir la proximité avec la notion d'électricité et le partage d'une unité souvent utilisée en physique.
Une application : la pile
 |
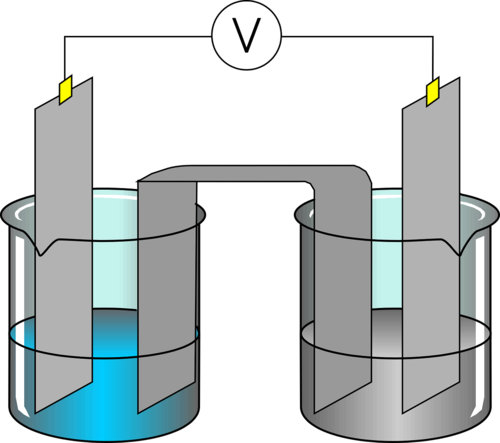
La pile a un pôle positif
Si le pôle est positif, c'est qu'il manque d'électrons, que ces électrons partent du métal de cette borne (appelé électrode et plus précisément cathode ; c'est à dire électrode positive).
Les électrons sont donc partis dans l'environnement de cette électrode, des électrons donnés à des cations métalliques afin de les transformer en élément neutre, la cathode se charge donc en matière métallique.
\[ \Large M^+ + e^- \rightarrow \; M\]
L'ion métallique prend des électrons, il s'agit donc de l'oxydant, qui se réduit ... A LA CATHODE, SE DEROULE LA REDUCTION.
|
|
La pile a un pôle négatif
Comme à une réduction, doit correspondre une oxydation, de l'autre côté, une électrode de signe opposé (signe négatif) est chargée en électrons et est appelée anode. Evidemment, il s'y déroule la réaction inverse de celle présente à la cathode :
\[ \Large M \rightarrow \; M^+ + e^-\]
Ici, des éléments de l'anode quittent l'électrode en y laissant leurs électrons. Le métal est donc le réducteur, il s'oxyde ... A L'ANODE, SE DEROULE L'OXYDATION.
|
 |
Comme nous l'avons vu, il faut que dans un système chimique, on ait une électroneutralité (pas de charge globale). La pile n'échappe pas à cette règle. Une pile ne fonctionnera que si on n'accumule pas les charges d'un côté et de l'autre de la pile. Il faut donc que les ions créés puissent trouver des anions ... mais il faut absolument éviter une fuite d'électrons qui eux, devront passer par un circuit externe pour effectuer un travail (et donc donner leur énergie). Il faut donc entre ces deux électrodes (cathode et anode) :
- une séparation évitant une fuite d'électrons
- un lien permettant de garantir l'électroneutralité
Cela peut paraître contraire mais il est important de les respecter pour que la pile fonctionne. On peut y arriver en réalisant deux opérations :
- séparer physiquement les deux électrodes (la pile comporte deux espaces physiquement distincts dans lesquels une électrode est entourré d'un environnement ionique avec lequel elle échange et qui se polarise donc)
- relier ces deux compartiments par un lien particulier appelé pont salin fortement concentré en un sel ionique (KCl par exemple). Cela permet d'éviter que les ions et les électrons des compartiments traversent le pont mais permet d'assurer l'électroneutralité des compartiments car les ions positifs ou négatifs de ce sel sortiront du pont salin afin de neutraliser la production ou la consommation d'ions.
|
|
|
 |
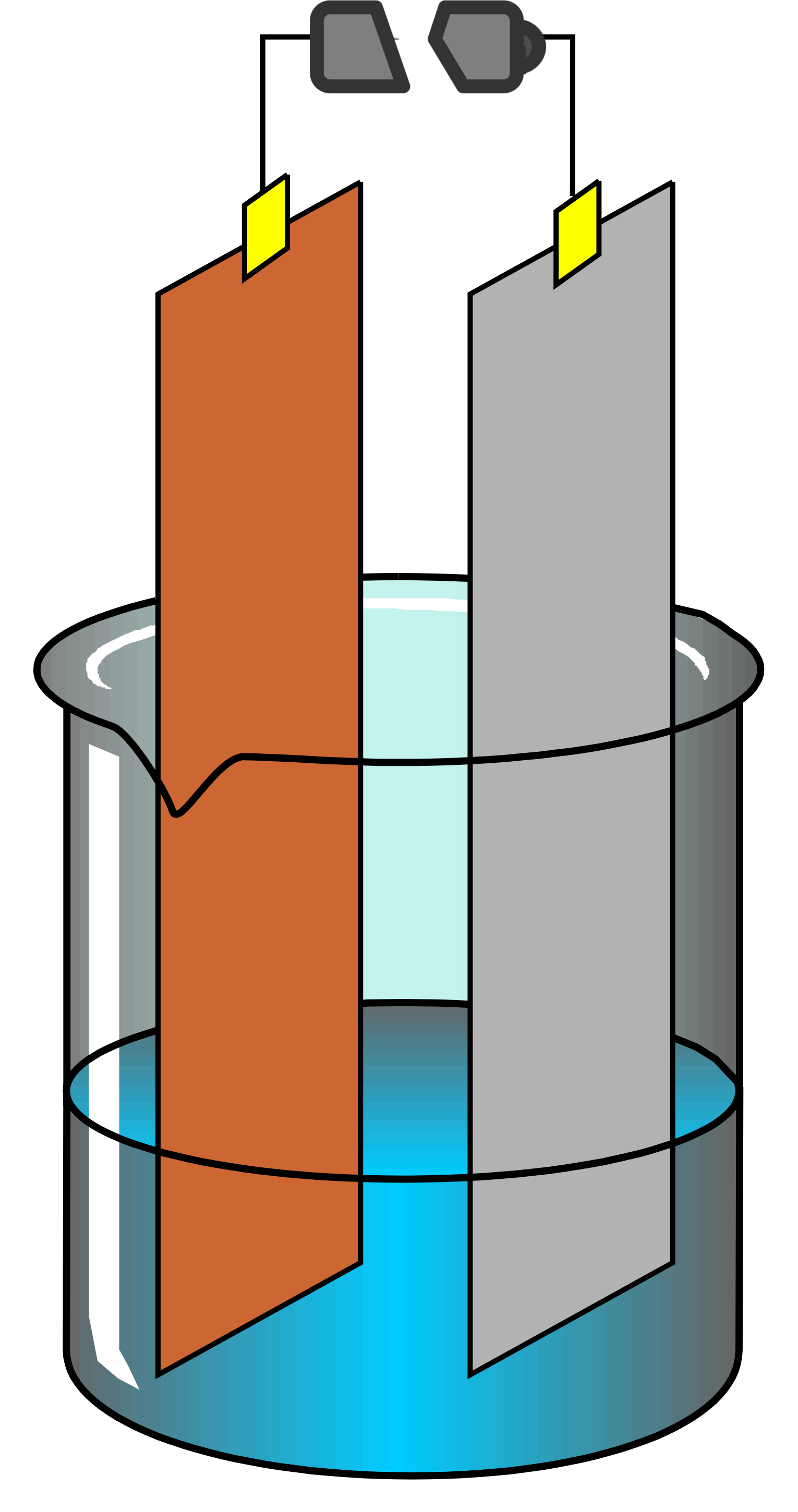
L'électrolyse est le parfait contraire d'une pile, on fournit du courant pour réaliser une réction chimique ... Les électrodes sont inversées, l'anode devient la cathode et inversément ! De nombreuses applications utilisent ce principe :
- le rechargement des piles
- la production de chlore à partir du chlorure de sodium dans la fabrication du PVC
- la production d'hydrogène
|
 |
 |
La différence de potentiel (en Volt) d'une pile se détermine par la différence entre le potentiel des deux électrodes Epile = E°cathode - E°anode. Mais il faudra tenir compte des concentration des ions dans les compartiments ....
|
 |
Compléter et équilibrer une rédox est une étape particulière
|
La pondération de ces équations est plus complexe que la pondération de toutes les autres équations (qui utilise simplement le calcul mental). Ici de nombreux paramètres doivent etre pris en compte :
- la rédox se passe en deux étapes ; une oxydation et une réduction
- il faut un équilibre de la matière dans chaque partie
- il faut un équilibre des charges dans chaque partie
- il faut tenir compte du milieu (acide, neutre ou basique)
Il nous faut donc une méthode afin d'y arriver rapidement :
\[\Large Na_2Cr_2O_7 + FeSO_4 \rightarrow \; Cr_2(SO_4)_3 + Fe_2(SO_4)_3 \;\;\;\;\; (Milieu \;acide : H_2SO_4)\]
partie 1 : une première demi-rédox
| Ecrire les réactifs et produits connus |
\[\Large Na_2Cr_2O_7 \rightarrow \; Cr_2(SO_4)_3 \] |
| Calculer les étages d'oxydation |
\[\Large \overset{+1} Na_2 \overset{+6} Cr_2 \overset{-2}O_7 \] |
\[\Large \overset{+3}Cr_2( \overset{+6}S \overset{-2}O_4)_3 \] |
Comment faire ?
 |
Deux possibilités : sans dessiner la molécule ou en la dessinant.
Avantages et inconvénients
La méthode la plus simple est de ne pas dessiner la molécule. Cette méthode, typiquement mathématique, fonctionne dans un grand nombre de cas. Dès que plusieurs atomes de nature identiques possèdent des étages d'oxydations différents dans une molécule, il faudra la dessiner. C'est toujours le cas en chimie organique.
Mathématiquement
On identifie l'étage d'oxydation des atomes qui n'en ont qu'un.
L'hydrogène
Son étage d'oxydation vaut toujours +1 sauf dans :
- H2 où il est égal à zéro
- les hydrures métalliques (ex : NaH) où il vaut -1
L'oxygène
Son étage d'oxydation vaut toujours -2 sauf dans :
- O2 où il est égal à zéro
- H2O2 où il vaut -1
Certains métaux
Certains métaux ne possèdent qu'un étage d'oxydation :
- les alcalins (famille Ia) : EO = +1
- les alcalino-terreux (Famille IIa) : EO = +2
- les terreux (Famille IIIa) : EO = +3
- Ag : EO = +1
- Zn : EO = +2
On identifie la charge globale de l'édifice moléculaire.
molécule
Par définition, une molécule est neutre. Elle ne possède aucune charge, la somme de tous les étages d'oxydation des atomes devra donc valoir zéro.
ion
Par définition, un ion est chargé. La somme de tous les étages d'oxydation des atomes devra donc être égale à la charge de l'ion.
On calcule l'étage d'oxydation manquant (on utilise une inconnue).
Exemple Na2Cr2O7
- Na est un alcalin : EO= +1
- Cr : EO inonnue, à déterminer
- O : EO = -2
C'est une molécule, la somme sera donc égale à zéro :
2 (+1) + 2x + 7 (-2) = 0
2x +2 - 14 = 0
2x = 12
x= 6 (EO du chrome = +6)
Exemple SO4--
- S : EO inconnue, à déterminer
- O : EO = -2
Il s'agit d'un ion dont la charge vaut -2. La somme des EO sera donc égale à -2
x + 4 (-2) = -2
x = -2 +8 = 6 (EO du S =+6)
Par dessin
Cette méthode nécessite de pouvoir dessiner la molécule. Une fois le dessin réalisé, on va analyser pour chaque liaison le nombre d'électrons que chaque atome gagne ou perd (en fonction des électronégativités).
- Lorsqu'un atome est plus électronégatif qu'un autre, il attire à lui les électrons, il gagne donc une charge -1 (on ajoute -1 à l'EO de l'atome)
- Lorsqu'un atome est moin électronégatif, c'est le contraire, on ajoutera +1 à l'EO)
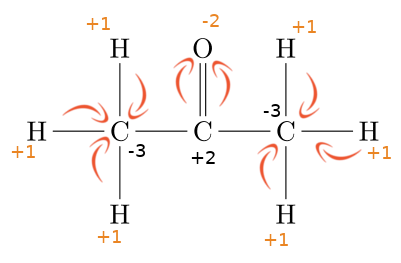
Dans cet exemple, nous utilisons les électronégativités pour attribuer les charges aux atomes :
- 2,2 pour H
- 2,5 pour C
- 3,5 pour O
Les H étant moins électronégatifs que les C, chacun verra son électron partagé s'éloigner en donnant une charge +1 à chaque H. Le C gagnera une charge négative à chaque fois.
Pour l'oxygène, étant plus électronégatif que le carbone, il attirera à lui les électrons mis en partage par le carbone. L'O gagnera des charges négatives (1 par liaison) pendant que le carbone gagnera des charges +.
Entre les atomes de carbone, il n'y a pas de déplacements d'électrons.
|
|
| Ne garder que les ions comportant les élements dont l'étage d'oxydation change |
\[\Large Cr_2O_7^{--}\rightarrow \; Cr^{+++} \] |
| Déterminer le nombre d'électrons échangés |
\[\Large Cr_2O_7^{--} + \color{red}{6e^-} \rightarrow \; 2Cr^{+++} \] |
| Equilibrer les charges |
\[\Large Cr_2O_7^{--} + 6e^- + \color{red}{14H^+} \rightarrow \; 2Cr^{+++} \] |
| Equilibrer la matière |
\[\Large Cr_2O_7^{--} + 6e^- + 14H^+\rightarrow \; 2Cr^{+++} + \color{red}{7H_2O}\] |
partie 2 : l'autre demi-rédox
| Ecrire les réactifs et produits connus |
\[\Large Fe^{++} \rightarrow \;Fe^{+++} \] |
| Calculer les étages d'oxydation |
\[\Large\overset{+2} Fe^{++} \] |
\[\Large \overset{+3} Fe^{+++} \] |
| Ne garder que les ions comportant les élements dont l'étage d'oxydation change |
\[\Large Fe^{++} \rightarrow \;Fe^{+++} \] |
| Déterminer le nombre d'électrons échangés |
\[\Large Fe^{++} \rightarrow \;Fe^{+++} + e^-\] |
| Equilibrer les charges |
| Equilibrer la matière |
partie 3 : Associer les deux demi-réaction et y replacer les contre-ions
\[\Large \begin{array}{c|rrrr}& Cr_2O_7^{--} &+ &6e^- & +&14H^+&\rightarrow&2Cr^{+++}&+&7H_2O\\ &&&&& Fe^{++}&\rightarrow&Fe^{+++}&+&e^-\\ \hline & & & & \end{array}\]
Faire en sorte que le nombre d'électrons soit identique dans les deux demi-réactions, cela peut nécessité d'en multiplier une ou de multiplier les deux.
\[\Large \begin{array}{c|rrrr}& Cr_2O_7^{--} &+ &6e^- & +&14H^+&\rightarrow&2Cr^{+++}&+&7H_2O\\ \color{red}{x6}&&&&& \color{red}{6}Fe^{++}&\rightarrow&\color{red}{6}Fe^{+++}&+&\color{red}{6}e^-\\ \hline & & & & \end{array}\]
On peut alors les additionner, les électrons s'annulent. Nous obtenons l'équation 'ionique'.
\[\Large \begin{array}{c|rrrr}& Cr_2O_7^{--} &+ \require{cancel} \cancel{6e^-} & +&14H^+&\rightarrow&2Cr^{+++}&+&7H_2O\\ &&&& 6Fe^{++}&\rightarrow&6Fe^{+++}&+ \cancel{6e^-}\\ \hline & Cr_2O_7^{--} &+ 6Fe^{++} & +&14H^+&\rightarrow&2Cr^{+++}&+&7H_2O &+&6Fe^{+++}\end{array}\]
Finalement, on peut ajouter les contre-ions, ceux que nous avions enlevé au début. Il faut s'assurer que la matière ajoutée à gauche est identique que cele ajoutée à droite car avant cela, l'équation était pondérée. Nous obtenons l'équation 'moléculaire'.
\[\Large \underbrace{\underbrace{\color{red}{Na_2}Cr_2O_7}_{+2Na^+} + \underbrace{6Fe\color{red}{SO_4}}_{+6SO_4^{--}}+\underbrace{\color{red}{7H_2SO_4}}_{+7SO_4^{--}}}_{+ 2Na^+\; et\; +13SO_4^{--}} \rightarrow \underbrace{ \underbrace{\color{red}{Cr_2(SO_4)_3}}_{+3SO_4^{--}}+7H_2O+ \underbrace{\color{red}{3Fe_2(SO4)_3}}_{+9SO_4^{--}}\color{red}{+} \underbrace{\color{red}{Na_2SO_4}}_{+ 2Na^+\; et\; +1SO_4^{--}}}_{+ 2Na^+\; et\; +13SO_4^{--}}\]