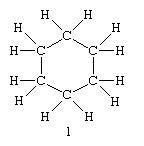
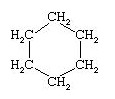
Dans les débuts de la chimie organique, lorsque le nombre de composés qu'elle avait recensés était encore restreint, ceux-ci recevaient des noms particuliers, rappelant souvent leur origine ("menthol" retiré de l'essence de menthe, "acide formique" provenant de la fourmi). Puis le nombre des composés organiques augmentant très rapidement, il a fallu instituer une nomenclature systématique, c'est à dire fixer des règles assurant un langage commun entre tous les chimistes. Ces règles permettent d'associer à chaque formule développée un nom qui ne peut appartenir qu'à elle et, inversement, d'établir sans ambiguité à partir d'un nom la structure du composé qu'il désigne.
Ces règles sont établies par un organisme international, l'UICPA (Union International de Chimie Pure et Appliquée, souvent désigné par son terme anglais IUPAC). On utilise cependant aussi des noms particuliers, consacrés par l'usage, mais non conformes à la nomenclature systématique.
Le nom attribué à une molécule se construit par la réunion, dans un ordre et selon des règles d'écriture strictement déterminées, d'éléments traduisant chacune de ses particularités. Il n'est pas indispensable que tous les groupes soient présents. Certaines molécules ne comportent pas de fonction chimiques ; leur nom ne comporte donc pas de suffixe. Si en plus, elles ne sont pas ramifiées ; leur nom ne comporte alors pas de préfixe.
 |
La chaîne principale est numérotée en respectant les règles ci-dessous. On applique dans l'ordre (c'est à dire qu'on ne considère le critère + que si le critère ne permet pas de trancher) :
Le nom des substituants,des fonctions (préfixes et suffixes) et des insaturations est systématiquement précédé du numéro du carbone de la chaîne principale auquel ces ramifications et fonctions sont attachées. Ce numéro est précédé et suivi par des tirets. Lorsqu'il y a plusieurs substituants du même type, on préfixe de « di », « tri », « tétra », « penta », « hexa », … et on indique toutes les positions séparées par des virgules. |
 |
Nernst, un outil pour calculer les potentiels |
||||
Finalement, il peut être important de pouvoir déterminer la différence de potentiel d'une pile ou de pouvoir déterminer les concentrations en forme oxydée ou réduite. Pour ce faire, nous devons corriger le E° du couple en tenant compte des concentrations ainsi que du nombre d'électrons échangés par le couple.
\[\Large E=E° + \frac{0,059}{n_{e^-}}. log(quotient\; réactionnel)\]
\[\Large E=E° + \frac{0,059}{n_{e^-}}.log( \frac{[red]^{coefficient \;stoechiométrique}}{[ox]^{coefficient \;stoechiométrique}})\]
 |
La structure de cette formule ne vous rappelle rien ? \[\Large Paramètre=Constante + log( Rapport \;de\; concentration)\]
Nernst\[\Large E=E° + \frac{0,059}{n_{e^-}}+ log( \frac{[red]^{coefficient \;stoechiométrique}}{[ox]^{coefficient \;stoechiométrique}})\]
Mélange acide et base conjuguée\[\Large pH=pKa + log( \frac{[Forme basique]}{[Forme acide]})\]
C'est normal, nous avons vu que selon la théorie de Lewis, l'acidité n'était qu'un échange d'électrons ... par paire ... Il y a donc logiquement un lien entre les deux chapitres ! |
 |
Comme toujours, lorsqu'il y a des ions H3O+ ou OH- dans le quotient réactionnel, il y a un lien avec le pH ! |
|
Les réactions d'oxydation ou de réductions sont omniprésentes dans notre monde. Elles nous sont très utiles (feu, nettoyage, assainissement, protection des aliments) mais elles sont aussi fondamentales pour tout être vivant. La respiration, la photosynthèses mettent en jeu ce type de réactions. Il est donc très important de les comprendre ... |
 |
Quelques définitions |
||||
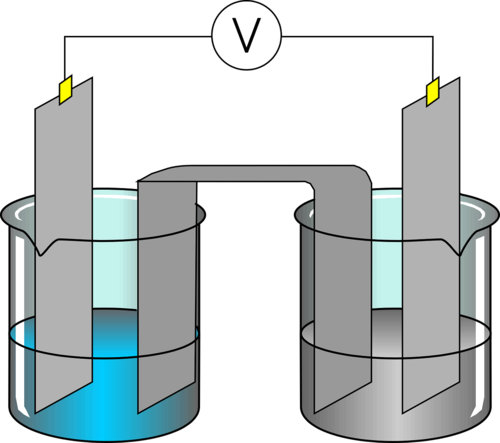
Les réactions d'oxydo-réduction sont définies par un échange d'électrons un par un (et non plus de doublets) entre deux partenaires, un oxydant et un réducteur. Nous pouvons facilement montrer ce transfert d'électrons par l'attaque des métaux par les acides. En effet, un grand nombre de métaux réagissent avec beaucoup d'acides, par exemple ici le zinc avec l'acide chlorhydrique : Dans cet exemple, le zinc (élémentaire) n'a aucune charge. Après réaction avec l'acide, il y a eu formation d'un sel, le chlorure de zinc qui amène le zinc à porter une charge +2. Cette charge marque la perte de deux électrons, ce sera aussi l'étage d'oxydation du zinc dans ZnCl2. L'association de ces deux réactions est appelée oxydo-réduction. Comme il y a échange d'électrons, il y aura une modification des étages d'oxydation de certains éléments. C'est une caractéristique qui permet facilement de déterminer que nous sommes devant une telle réaction. Comme la réaction de réduction est l'inverse de l'oxydation, chaque réaction sera réversible, elles seront donc toutes équilibrées ... Par contre, associer une réaction d'oxydation et une réaction de réduction pourra permettre des réactions complètes, cela dépendra de leur force ! Attention, deux définitions viennent parfois semer le trouble : A nouveau, nous aurons des couples, appelés couples rédox auquels sera associée une valeur qui caractérisera la force du couple (oxydant ou réducteur fort ou faible). Cette valeur est appelée Potentiel standard (noté E°) et exprimé en Volts. Comme il s'agit de transfert d'électrons, nous ne serons pas étonnés de voir la proximité avec la notion d'électricité et le partage d'une unité souvent utilisée en physique.
\[ \Large Zn + 2\;HCl \rightarrow \; ZnCl_2 + H_2\]

Au final donc un oxydant se réduit (il passe donc d'une forme oxydée à une forme réduite) et un réducteur s'oxyde (il passe d'une forme réduite à une forme oxydée).
 |
Compléter et équilibrer une rédox est une étape particulière |
||||
La pondération de ces équations est plus complexe que la pondération de toutes les autres équations (qui utilise simplement le calcul mental). Ici de nombreux paramètres doivent etre pris en compte :
- la rédox se passe en deux étapes ; une oxydation et une réduction
- il faut un équilibre de la matière dans chaque partie
- il faut un équilibre des charges dans chaque partie
- il faut tenir compte du milieu (acide, neutre ou basique)
Il nous faut donc une méthode afin d'y arriver rapidement :
\[\Large Na_2Cr_2O_7 + FeSO_4 \rightarrow \; Cr_2(SO_4)_3 + Fe_2(SO_4)_3 \;\;\;\;\; (Milieu \;acide : H_2SO_4)\]
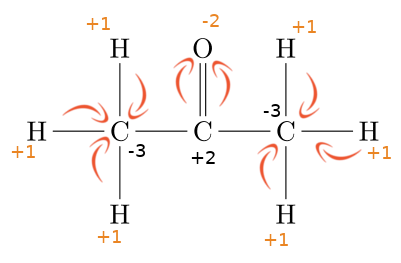
La richesse de ces molécules en terme de diversité, a obligé le chimiste à abandonner ou à enrichir les représentations que nous utilisions en chimie minérale.
 |
La conception orbitalaire : une couche importante du modèle ! | ||||
Le modèle de Bohr a ses limites, il a donc fallu l'améliorer afin de remédier aux problèmes rencontrés. C'est la naissance d'un nouveau modèle appelé modèle orbitalaire qui modifie fondamentalement le déplacement des électrons autour du noyau. Il a pour origine tous les travaux effectués dans le cadre de ce que l'on appelle la "mécanique quantique".
Qu'est-ce que la mécanique quantique ?
La mécanique quantique vient modifier la vision dite classique de la physique, basée sur les lois de Newton. Alors que la mécanique classique permet fort bien d'expliquer les phénomènes macroscopiques (le déplacement d'objets par exemple), elle ne permet pas de rendre compte de phénomènes que subissent les particules très petites telles que les électrons, les protons ou les neutrons.
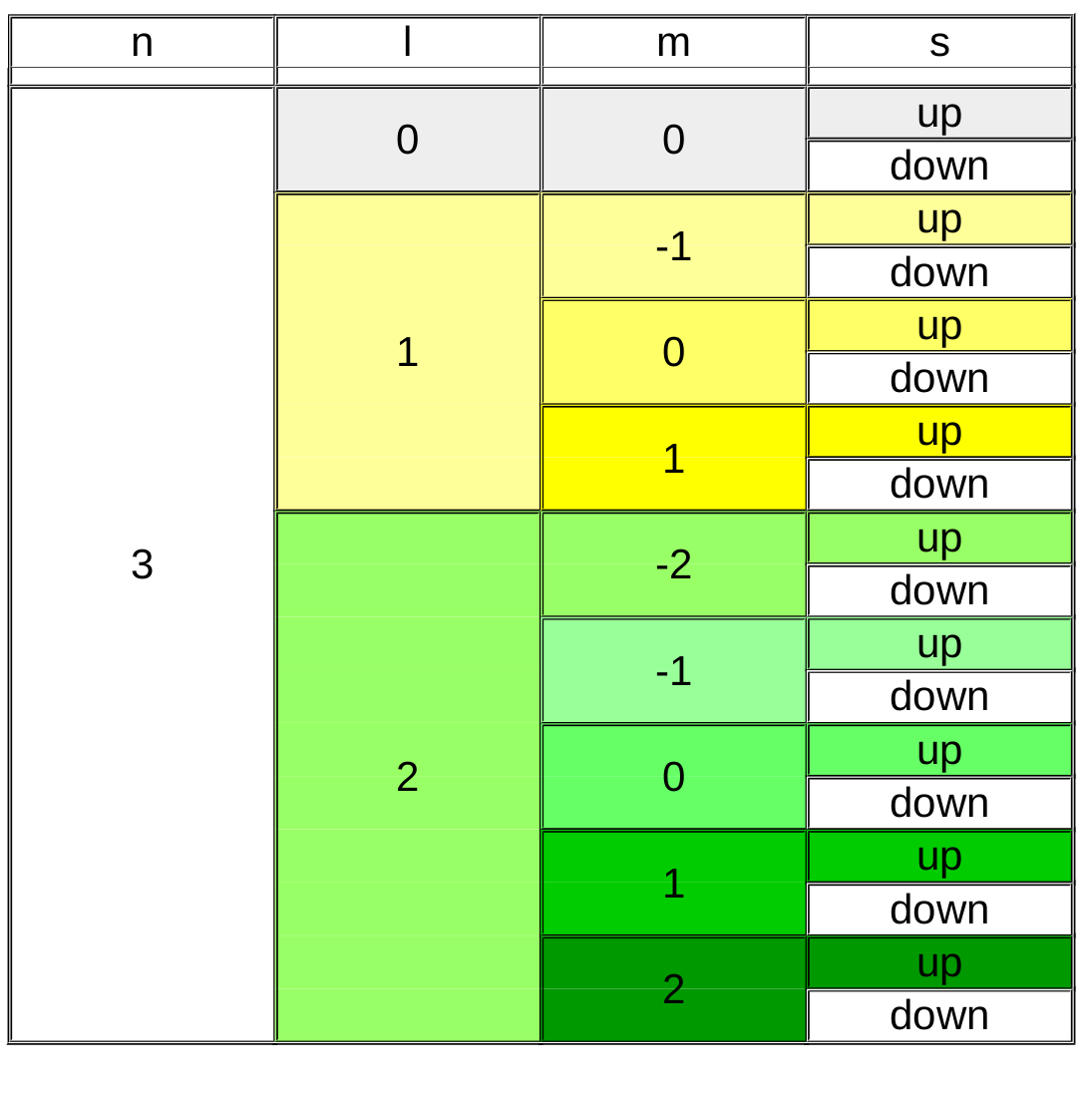
4 nombres quantiques pour définir la structure électronique
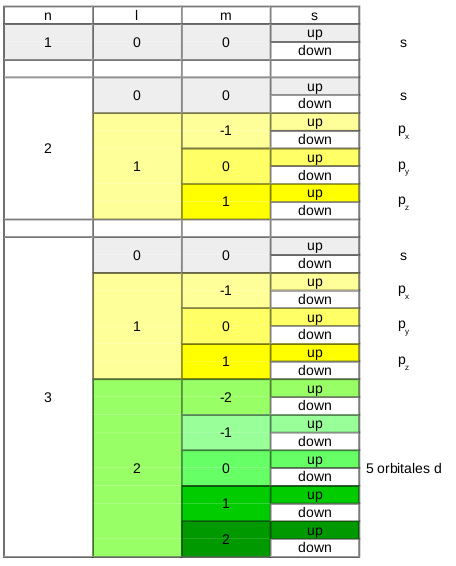
La théorie postule l'existance de 4 nombres quantiques. Ceci signifie que leur existence n'a pas été démontrée mais tant que l'on ne peut démontrer leur non existence, on peut présumer qu'ils existent.
Ces 4 nombres sont :
- n : le nombre quantique principal
- l : le nombre quantique secondaire ou azimutal
- m : le nombre quantique magnétique
- s : le nombre quantique de spin
Chaque nombre représente une caractéristique pour l'orbitale ou l'électron. A eux 4, ils permettent d'identifier un électron particulier. La même série des 4 nombres ne peut donc pas être attribuée à deux électrons différents.
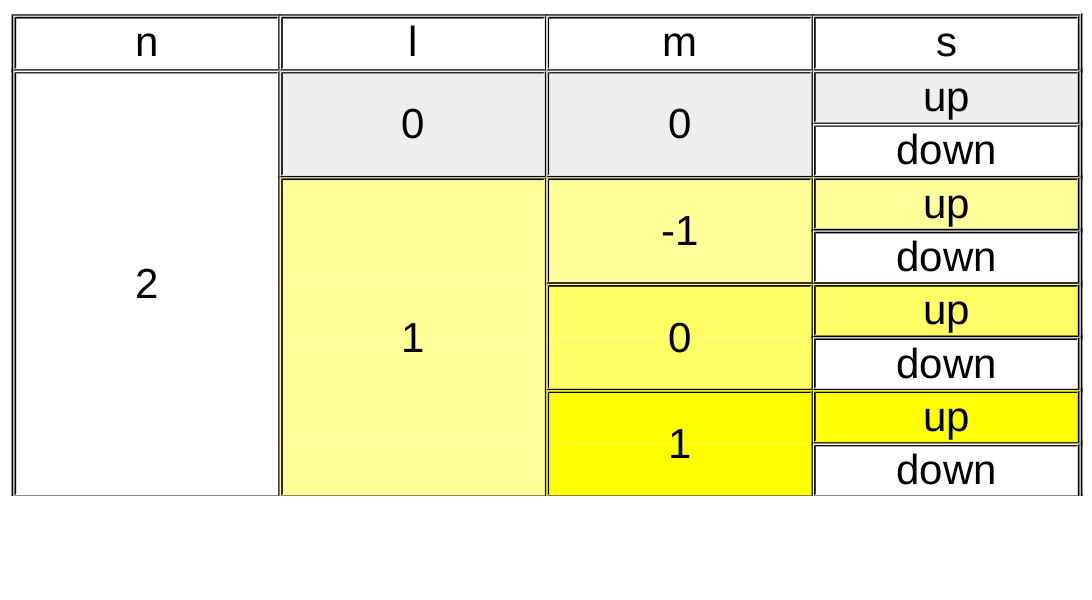
Le nombre quantique principal (n) est de loin le plus facile à comprendre, il désigne la couche électronique et prend des valeurs entières (1,2,3,4,...) ... C'est celui que nous connaissons aussi chez Bohr et qui est présent dans le tableau périodique pour numéroter chaque période.
Le nombre quantique secondaire (l) va donner une forme à l'orbitale. Sa valeur sera liée à la valeur du nombre quantique principal : sa valeur sera comprise entre 0 et n-1.
Le nombre quantique magnétique (m) oriente l'orbitale dans l'espace. Sa valeur sera liée à la valeur du nombre quantique secondaire et sera comprise entre -l et +l.
Finalement, le nombre quantique de spin (s) caractérise la rotation de l'électron sur lui même et ne peut prendre que deux valeurs :
- spin up = +1/2
- spin down = -1/2
Le fait que le spin ne peut prendre que deux valeurs et que les 4 nombres quantiques ne peuvent être identiques pour deux électrons différents impose qu'une orbitale ne peut contenir que deux électrons {Principe de Pauli}.
Un outil simple pour déterminer la structure électronique
Nous sommes loin d'avoir vu toute la théorie orbitalaire. Nous remarquons qu'il y a des particularités dans l'apparition successive des orbitales.
Nous pouvons établir la structure élecronique des éléments en suivant le tableau périodique case par case comme nous l'avons fait plus haut. Mais il existe un moyen mnémotechnique, plus simple, plus rapide pour prévoir la structure électronique des éléments assez fidèlement. L'utiliser nous permettra de déterminer la structure électronique de chaque élément. Attention, il restera quelques particularités dont nous ne parlerons pas ici.
|
Le principe est simple. Il suffit de construire le tableau de gauche puis detracer des flèches diagonales barrant les cases en partant du coin supérieur droit au coin inférieur gauche. La succession des orbitales se construit alors en suivant les flèches les unes après les autres en commençant par le haut. La lecture nous donne : 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s ... |
|
|
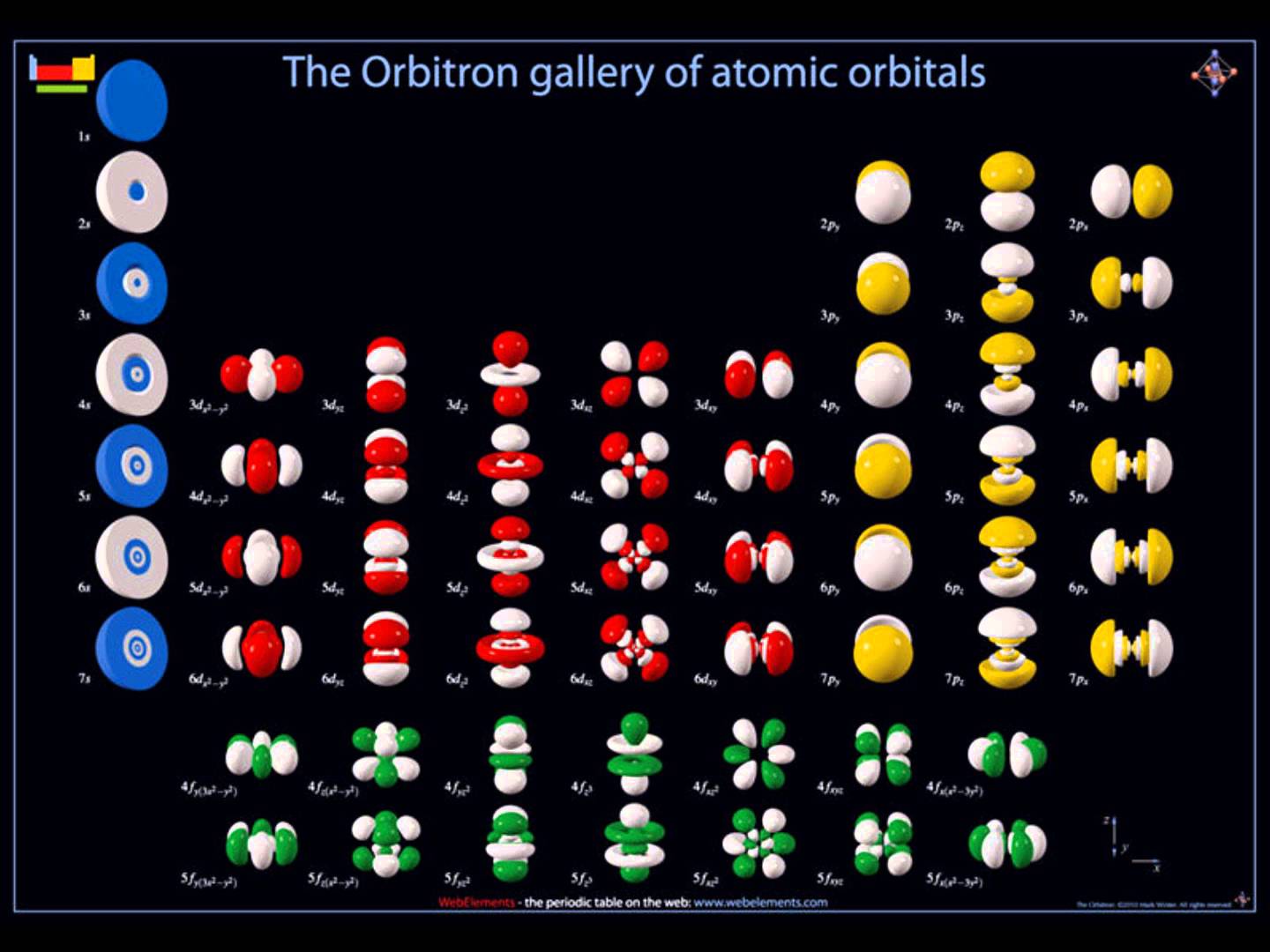
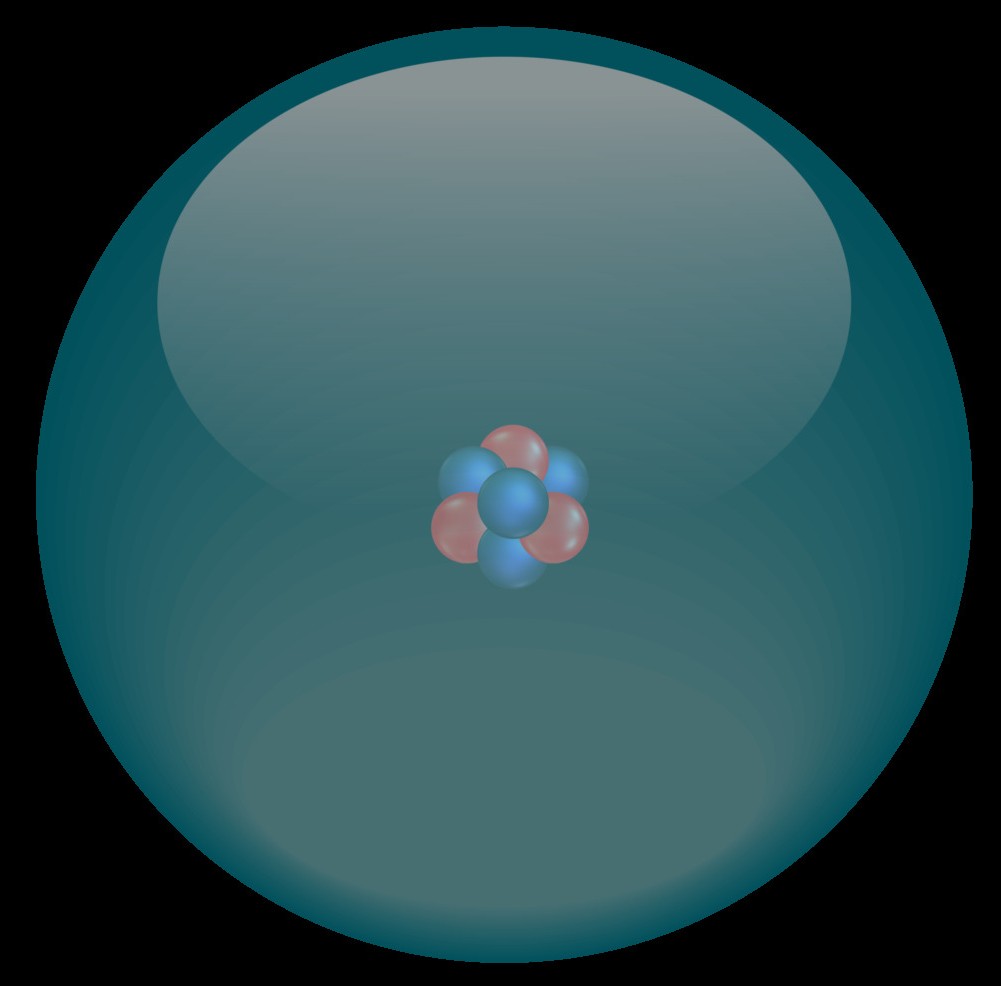
A quoi ressemblent les orbitales ?
Les orbitales sont en réalité des fonctions mathématiques dont les volumes sont déterminés par calcul (calcul ab initio). Afin de ne pas compliquer inutilement notre apprentissage, nous ne chercherons à visualiser que deux types d'orbitales atomiques : les orbitales s et les orbitales p. A chaque couche, les orbitales grandissent.
 |
 |
|
|
|
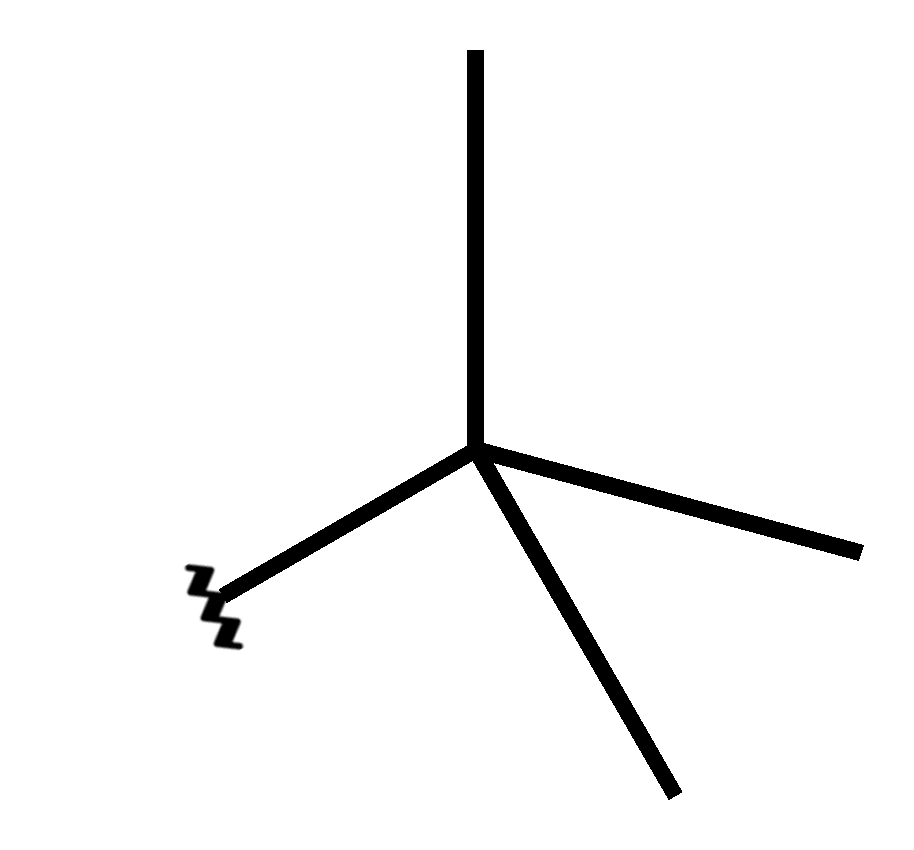
Les orbitales de type p sont composées de deux lobes orientés dans une direction de l'espace cartésien (x,y et z). Cette représentation est inspirée du travail de Dhatfield — File:P2M0.png, CC BY-SA 3.0. |
|
 |
|
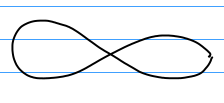 |





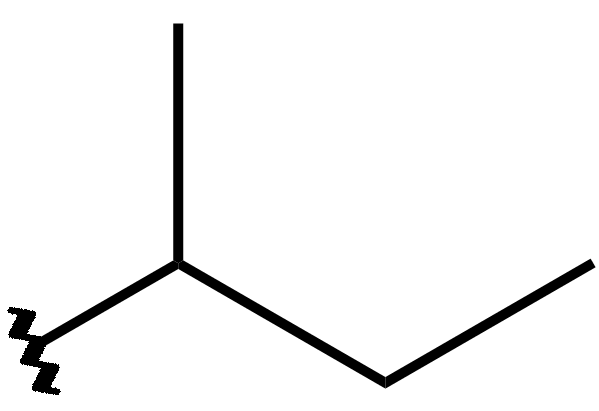
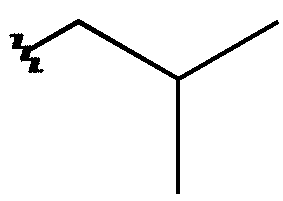
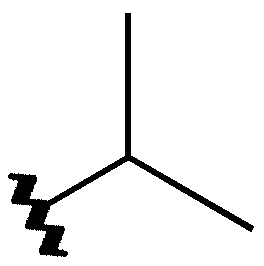
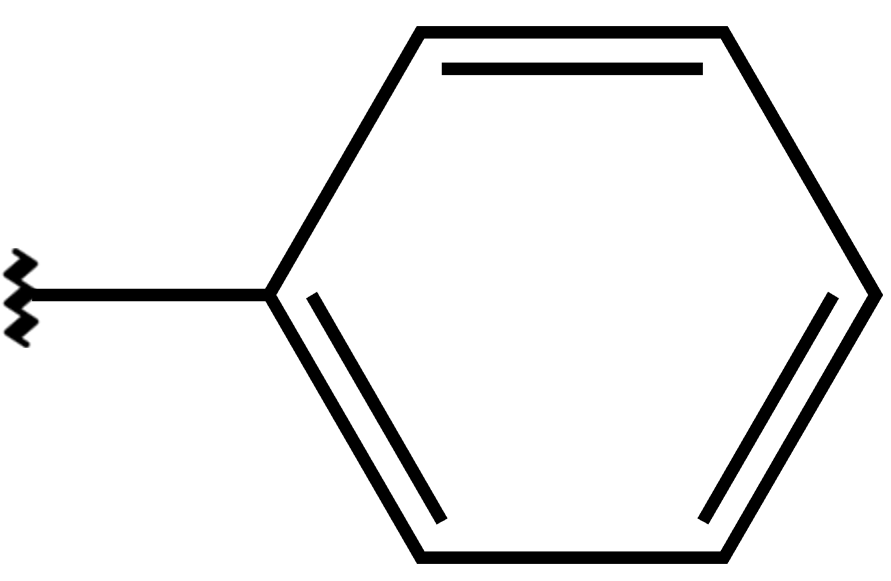


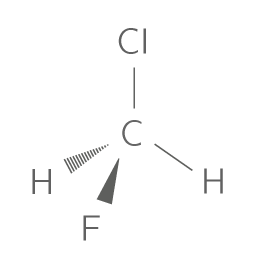
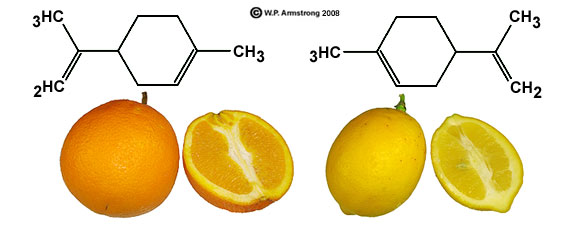 Voici un exemple concret d'une toute petite différence de structure :
Voici un exemple concret d'une toute petite différence de structure :