Apprendre
 |
Les liaisons, ces liens chimiques particuliers
|
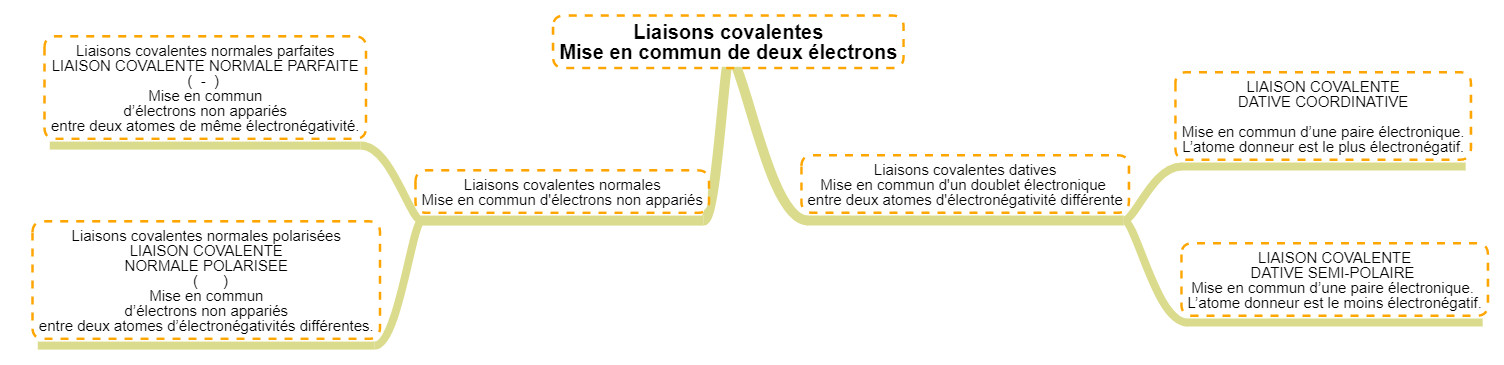
Réaliser une liaison chimique c'est donc ... partager les électrons (les mettre en commun). Comme il existe des électrons célibataires et des doublets électroniques sur la dernière couche des éléments, il y aura deux grands types de liaisons différentes. Toutes les liaisons sont appelées liaisons COVALENTES car elles lient deux atomes.
Laisons normales
Le premier type de liaison est celui auquel on s'attend selon la théorie atomique : deux atomes possédant chacun un électron célibataire vont chercher à le mettre en commun afin de créer un doublet (qui est une configuration plus stable).
Lorsque deux atomes possédant chacun un électron célibataire s'approchent l'un de l'autre
|
ils vont former une liaison en mélangeant les deux orbitales atomiques (rouge et jaune) afin decréer deux orbitales moléculaires :
- une de basse énergie dite liante (en bleu)
- une de plus haute énergie dite anti-liante (non représentée)
Les électrons se retrouvent donc dans une seule orbitale de plus faible énergie (bleue) et forment un doublet (liaison). La densité électronique est maintenant centrée sur le milieu de la liaison et non plus sur chaque noyau atomique. Il y a bien partage des électrons.
|
|
En fonction de la différence d'électronégativité des atomes, il peut y avoir deux types de liaison normales :
|
Lorsque les deux atomes qui se lient ont strictement la même électronégativité, on a une liaison totalement symétrique. Les deux électrons partagés sont parfaitement au milieu des deux atomes. Aucun atome ne tire à lui ces électrons.
Exemple : la molécule de H2 : H-H. C'est le cas de toutes les molécules diatomiques symétriques (O2, N2, Cl2,...) qui sont composées de liaisons covalentes normales parfaites puisqu'elles sont constituées de deux atomes identiques.
|
|
|
Si par contre il y a une différence d'électronégativité, la répartition des électrons sera asymétrique. L'atome le plus électronégatif tirera à lui les électrons de la liaison. Ceci veut dire que :
- l'atome le moins électronégatif perd donc potentiellement son électron. Perdant une charge négative, nous allons lui attribuer une charge partielle positive (partielle car il n'a pas totalement perdu son électron, il le voit juste moins)
- L'atome le plus électronégatif, lui, gagne potentiellement un électron (une charge négative) ; on lui attribuera une charge partielle négative (delta -).
Exemple : La molécule de HCl : H-Cl montre une différence importante d'électronéativité entre les deux atomes. L'atome de chlore (électronégativité de 3) portera une charge partielle négative alors que l'atome d'hydrogène (électronégativité de 2,1) portera une charge partielle positive (delta +).
Remarque : la différence d'électronégativité ne doit pas dépasser 1,7. Si cette valeur est dépassée, un des deux atome arrachera l'électron de l'autre. Il n'y aura donc plus d'électrons mis en commun, il n'y aura plus de liaison.
|
|
|
| |
|
Lorsque un atome prend un électron à un autre, on a plus de liaison entre eux, nous avons des ions. Nous parlerons alors de charge formelle. Nous aurons une paire d'ions :
- un ion positif (cation) pour celui qui a perdu son électron que nous noterons C+ où C représente le symbole de l'atome
- un ion négatif (anion) pour elui qui a gagné un électron que nous noterons C- où C représente le symbole de l'atome.
|
|
|
Par contre, dans le cas d'une liaison polarisée, il n'y a pas de capture d'un électron par l'atome le plus électronégatif, il y a juste un déplacement de la densité électronique de la liaison vers l'atome le plus électronégatif. Alors que dans une liaison normale parfaite, il y a une densité électronique symétrique et centrée sur le milieu de la liaison, ici, nous verrons une dissymétrie.
Il faut alors trouver une solution pour aratériser ce déplacement de charge. Nous ne pouvons pas, comme avant, placer des + ou des - car nous n'avonns pas de charge formelle. Nous allons alors attribuer à chaque atome une charge partielle (notée delta minuscule) suivie d'un + ou d'un - pour dire qui a une densité électronique plus importante ou moins importante.
A droite, une animation, montrant cette dissymétrie et les charges partielles. En bas, des exemples de molécules (CO2 et NH3) montrant les portions de charges attribuées à chaque atome. Comme ces charges sont inférieures à 1, on voit qu'elles sont bien partielles.
|
|
|
|
|
Liaisons datives
Le second type de liaison, est différent du premier car il ne s'agit plus ici de mettre en commun des électrons célibataires mais de partager le doublet libre d'un des deux atomes.
|
Pour réaliser ce type de liaison il faut absolument :
- un atome qui possède un doublet libre et qui est capable de le partage
- un atome qui a une orbitale libre pour accepter les électrons venus du premier atome.
Evidemment, ce partage passe également par le mélange des orbitales atomiques concernées et la formation d'une orbitale moléculaire.
|
|
Il existe à nouveau deux type de liaisons datives en fonction des différences d'électronégativité des atomes :
- les dative coordinatives lorsque l'atome qui donne le doublet est plus électronégatif que celui qui l'accepte
- les datives semi-polaires lorsque l'atome qui donne le doublet est moins électronégatif que celui qui l'accepte.
Les liaisone datives coordinatives sont bien moins solides que les autres, ceci s'explique par le caractère inhabituel du partage puisque ce n'est généralement pas l'atome le plus éectronégatif qui donne ses électrons. Cette liaison est cependant très importante en chimie car elle est présente dans les ions H3O+ et NH4+.
Voici un résumé visuel :
L'énergétique des liaisons chimiques
|
La formation d'une liaison chimique est un processus dit stabilisant pour le système. En chimie, un système est d'autant plus stable qu'il contient peu d'énergie. On peut comparer cela à un élastique. L'élastique au repos, posé sur une table est bien plus stable que si on l'étire car au repos, il contient moins d'énergie.
A l'opposé, casser une liaison demande de l'énergie.
Ce phénomène et son suivi énergétique est montré par l'animation suivante :
|
|
Lien avec les éléments et le tableau périodique
Nous avons eu, dans le chapitre de l'atome, une courte discussion sur cette tendance qu'à un atome à se stabiliser en gagnant ou en perdant des électrons. Maintenant que nous avons abordé complètement la formation des liaisons, nous pouvons compléter notre pensée ...
Nous considérerons que tout élément qui se lie à un atome plus électronégatif que lui verra son électron partagé s'éloigner de lui. Tant que la différence d'électronégativité entre les deux atomes ne dépasse pas 1,7, il y aura toujours partage des électrons et donc liaison, nous attribuerons aux atomes des charges partielles (positive pour le moins électronégatif, négative pour l'autre).
Si par contre cette différence est supérieure à 1,7, le plus électronégatif gagnera les électrons partagés, il n'y aura plus de liaison mais une paire d'ions. Dans ce cas, nous attribuerons une charge formelle à chaue atome (positive pour le moins électronégatif et négative pour l'autre).
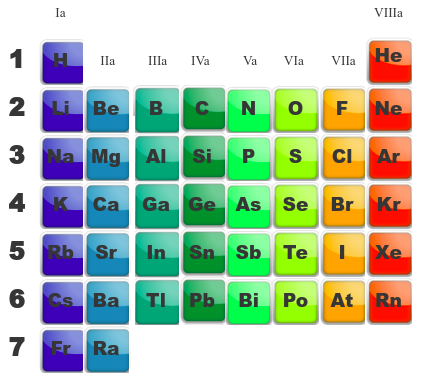 |
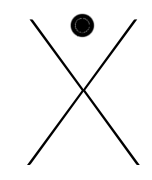
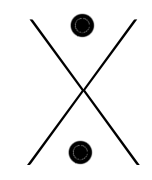
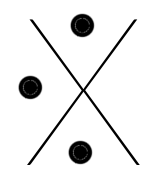
Les éléments de gauche (les familles Ia, IIa et IIIa), les métaux, ont un, deux ou trois électrons en plus qu'un gaz rare, ils auront tendance à les perdre pour ressembler plus facilement à un gaz inerte : le précédent.
Ils feront donc 1,2 ou 3 liaisons covalentes normales avec des éléments possédant des électrons célibataires. Etant fort électronégatifs, ils auront tendance à attirer les électrons à eux et, si la différence d'électronégativité devient grande, à former des ions respectivement de charge -1,-2 ou -3.
|
 |
 |
 |
|
Les éléments de droite (les familles VIIa, VIa et Va), ont à peu de chose près, la structure d'un gaz rare, il leur manque un, deux ou trois électrons. Ils auront plus facile de prendre les électrons qui leur manque.
Ils réaliseront respectivement 1, 2 ou 3 liaisons avec d'autres éléments en partageant leurs électrons célibataires. Si ces éléments, avec qui ils s'associent, sont bien plus électronégatifs qu'eux, ils génèreront des ions chargés respctivement +1,+2 ou +3 ... On dira qu'ils cèderont leurs électrons afin se se retrouver avec la configuration électronique du gaz inerte qui les précèdent.
|
 |
 |
 |
 |
La "règle de l'octet" a ses limites
La règle de l'octet qui prévoit que tout élément cherchera à faire des liaisons pour s'entourer de 8 électrons (d'où l'octet) et ressembler au gaz rare le plus proche est souvent utilisée pour expliquer la formation d'ions à partir des éléments. Il faut prendre conscience que la règle de l'octet est loin de s'appliquer à tous les éléments. AInsi, elle fonctionne pas mal du tout pour les éléments des familles A, sauf pour :
- les alcalino-terreux qui n'ont que trois électrons célibataires sur leur dernière couche et qui seront donc souvent entourrés de 6 electrons. Ces éléments peuvent par contre accepter un doublet. Ainsi la molécule d'Al(OH)3, peu soluble, se redissous à pH élevé en formant un complexe de structure Al(OH)4-
- L'hydrogène dont la première et seule couche électronique sera complète avec deux électrons.
Malgré cela, de nombreux atomes des familles A, dans certains cas ne la respecteront pas ... Et ce sera particulièrement le cas lorsqu'il désaparieront un doublet.
Cette règle de stabilité ne fonctionne pas non pour les familles B.
Il est donc primordial de comprendre quelles sont les conditions qui permettent à un élément de former des ions stables ... et pour cela, nous avons besoin de la théorie orbitalaire.
|
 |
|
Ce n'est pas parce qu'un atome possède un doublet électronique, qu'il fera des liaisons datives !
En réalité, bon nombre d'atomes peuvent leur doublet afin de réaliser des liaisons covalentes normales.
Les principaux atomes qui ne le peuvent pas sont l'oxygène et l'azote
|
 |
Patager des électrons, c'est aussi potentiellement en gagner ou en perdre
|
Les atomes partagent des électrons pour faire des liaisons et en fonction de leur ... les électrons se rapprochents d'un atome et s'éloignent de l'autre.
Ce déplacement d'électrons amènent une différence dans l'entourage électronique des atomes par rapport à celle de l'élément dans le tableau périodique. Nous attribuerons donc :
- une charge positive (+) chaque fois qu'un atome est lié à un atome plus électronégatif que lui
- une charge négative (-) chaque fois qu'un atome est lié à un atome moins électronégatif que lui
- pas de charge si cet atome est lié à un atome d'électronégativité identqiue.
Notons qu'une double liaison impliquera le transfert de deux électrons. Une triple impliquera le transfert de 3 électrons ...
 |
Classer les molécules
|
A partir des structures de Lewis des atomes et des différents types de liaisons, nous allons pouvoir assembler les atomes pour créer des molécules.
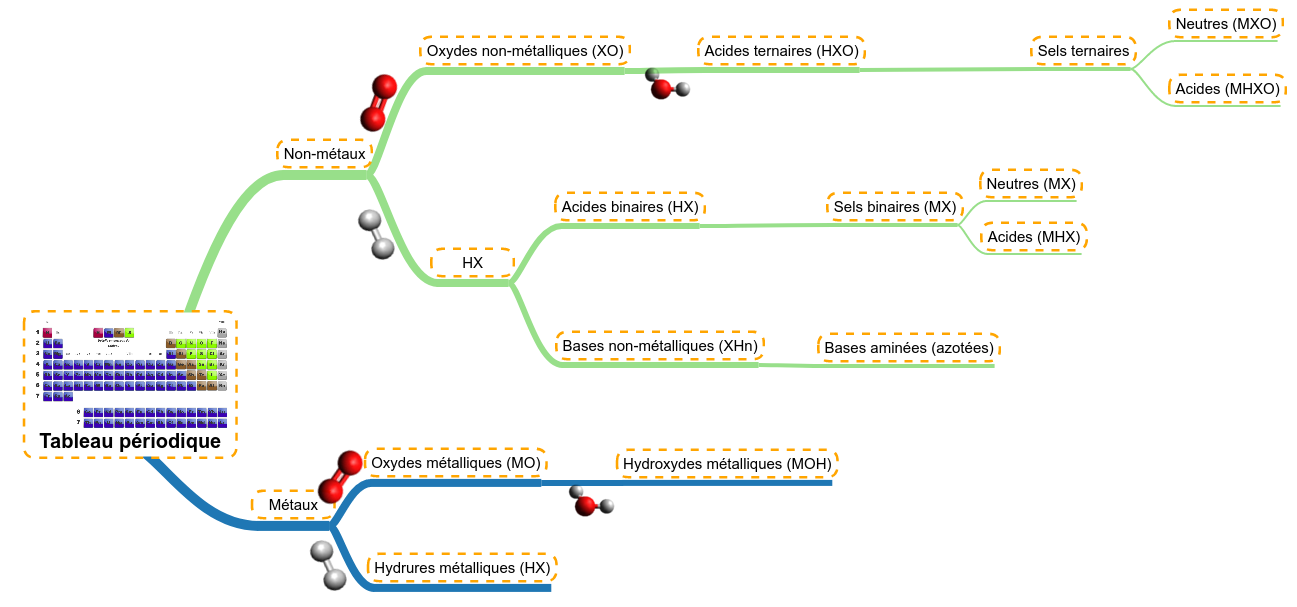
Mais avant cela, expliquons comment les molécules se créent à partir du tableau périodique et quels sont les différentes familles de molécules qui existent. Cela nous aidera pour la suite ....
Nous avons vu que dans le tableau périodique, on pouvait trier les atomes selon deux grandes tendances :
- ceux dont l'électronégativité était faible, à caractère métallique
- ceux dont l'électronégativité était bien plus élevée, à caractère non-métallique
Nous partirons donc de ces deux catégories afin d'appliquer 4 grands types de réactions :
- réaction avec de l'oxygène (oxydation)
- réaction avec l'eau (hydratation)
- réaction avec l'hydrogène
- réaction de neutralisation (nous en reparlerons plus longuement).
Explication du schéma
Le diagramme reprend toutes ces réactions afin de générer différents types de molécules. On y voit que :
- les métaux et les non-métaux réagissent tous les deux avec l'oxygène afin de générer des oxydes (MO et XO)
- les non-métaux peuvent-eux en plus réagir avec l'hydrogène afin de générer soit les acides binaires (HX) soit des bases (XHn)
Les oxydes formés peuvent réagir avec de l'eau afin de générer :
- les hydroxydes (MOH) qui ont un caractère basique
- les acides ternaires (HXO)
Nous remarquerons donc que les métaux ont tendance à former des molécules basiques (en bleu) et les non-métaux formeront majoritairement des molécules à caractère acide (en vert). Attention cependant, certains ions métalliques ont une tendance acide (nous en parlerons plus tard).
Finalement, les molécules à caractère basique peuvent réagir avec les molécules à caractère acide afin de former des sels :
- les sels binaires (MX) et hydrogénosels binaires (MHX) si la neutralisation d'un acide polyfonctionnel (avec plusieurs H acides) n'est pas complète
- les sels ternaires (MXO) et les hydrogénosels correspondants (MHXO)
Comment déterminer la famille d'une molécule et utiliser le schéma ?
 |
Le savoir-faire lié à la détermination de la famille des molécules nécessite d'avoir la formule moléculaire.
Il consiste à :
- Identifier le métal et le remplacer par le symbole "M"
- Identifier le non-métal et le remplacer par le symbole "X"
On ne remplace ni l'hydrogène, ni l'oxygène.
On ne note pas les indices qui indiquent le nombre de chacun des atomes présents dans la molécule.
|
 |
Déterminer la masse des molécules
|
Un paramètre important, dont nous nous servirons souvent en chimie, est la masse des molécules. Elle nous permettra de déterminer des quantités de matière par la suite.
La masse d'une molécule, c'est (simplement) la somme des masses des atomes qui la composent
Ainsi calculer la masse d'une molécule c'est faire des additions et des multiplications. Nous obtenons un chiffre exprimé en u.m.a ; la masse moléculaire.
La masse moléculaire relative est ce même nombre, divisé par 1 uma, soit, sans unité.
La masse molaire est toujours ce même nombre accompagné de l'unité (g/mol). Elle représente la masse d'une mole (6,02 1023 molécules) de ce corps.
Exemple pour le chlorure de cuivre (II)
Calculer la masse de CuCl2
Masse(CuCl2) = Masse (Cu) + 2x Masse(Cl)
En réalité, la masse d'une seule molécule est peu utile, simplement car lorsque nous pesons de la matière, nous pesons des grammes ... Ce qui représente beaucoup de molécules...
Nous en avons parlé, les masses des éléments et donc les masses moléculaires sont exprimées en uma (unité de masse atomique). Pour nous rendre compte de ce que cela représente, nous pouvons réaliser un petit calcul :
L'u.m.a est le douzième de la masse de 12C. Mais que vaut la masse du 12C exprimée en kg ?
La masse d'un atome est plus ou moins égale à la masse des protons, neutrons et électrons qui le composent, le 12C est composé de 6 protons, 6 neutrons et 6 électrons. En allant chercher les masses de ces particules exprimées en kg, nous pouvons déterminer cette masse :
| Particule |
Masse (kg) |
| Neutron |
1,6749 x 10 -27 |
| Proton |
1,6726 x 10 -27 |
| Electron |
9,1094 x 10 -31 |
Masse (12C) = 6x (1,6749 x 10 -27 kg + 1,6726 x 10 -27 kg + 9,1094 x 10 -31 kg = 1,992 × 10−26 kg
1u.m.a = Masse (12C) /12 = 1,992 × 10−26 kg / 12 = 1,66054 × 10−27 kg
Il s'agit donc d'une valeur extrêmement petite et ... impossible à peser. A chaque gramme pesé, nous pèserons donc un grand nombre de molécules.
Un grand nombre de molécules ... Une mole !
Pour résoudre le problème d'échelle entre le monde microscopique de l'atome et notre monde macroscopique dans lequel sont réalisées nos mesures (de masse, de volume), le chimiste à défini une quantité : 6,023 × 1023 et l'a appelé le nombre d'Avogadro. Ce nombre est très important car il permet facilement de faire le lien entre l'échelle microscopique (des atomes et des molécules en u.m.a) et notre monde macroscopique (g, kg).
Grâce à ce nombre, le chimiste défini ce qu'est une mole :
Une mole représente une quantité égale à 6,023 × 1023 entités (atomes, molécules, ...)
Et ce nombre n'est pas défini par hasard ... Essayons de voir combien pèse une mole de 12C
Pour cela, je dois prendre 6,023 × 1023 atomes de 12C, soit une masse de : 6,023 × 1023 x 1,992 × 10−26 kg = 0,012 kg = 12 g
Donc la mole est un outil très simple :
- si je prend un atome de 12C, il pèse 12 u.m.a
- si je prend une MOLE de 12C, elle pèse 12 g
La mole permet de passe de l'échelle microscopique à l'échelle macroscopique en gardant le même chiffre de masse mais en changeant juste l'unité pour qu'elle corresponde à nos unités de mesure. Dans le même temps, nous avons pris un grand nombre d'entités (6,023 × 1023).
N'oublions pas les cristaux !
 |
Actuellement, nous avons considéré les molécules toutes seules. Nous avons considéré que ces matières parfois solides ne comportaient pas d'eau (anhydre).
Ce n'est pas toujours le cas, il arrive bien souvent que nous ayons des substances cristallisées. Dans ce cas, un certain nombre de moécules d'eau sont présentes dans les cristaux, attachées aux molécules de ce corps. On fait alors suivre leur formule d'un point et du nombre de molécules d'eau attachées :
Cr(NO3)3•9H2O
Dès que l'on voit une telle structure, il faut ajouter à la masse de la molécule (le nitrate de chrome (III) dans notre exemple), la masse des molécules d'eau (on ajoutera ici 9x 18g/mol).
|
Comment faire ?
 |
Le savoir-faire lié à la détermination de la masse des molécules consiste à :
- Identifier le nombre d'atome de chaque type présent dans la molécule à l'aide
- des nombres en indice qui suivent le symbole
- des nombres en indice qui suivent des parenthèses enfermant de symbole
- éventuellement pour les cristaux, du nombre qui se situe juste avant un " • "
qui détermine le nombre de molécule d'eau attachées à chaque molécule du corps
- Multiplier ce nombre par la masse atomique relative (T.P)
- Adapter l'unité si besoin :
- u.m.a pour la masse moléculaire
- g/mol pour la masse molaire
- aucune unité pour la masse relative
|
 |
Certaines molécules en se cassant forment des ions ... polyatomiques, c'est la dissociation
|
|
Nous avons vu que les ions sont des particules chargées qui peuvent être monoatomiques (un atome qui gagne ou qui perd des électrons). Ces ions peuvent aussi être polyatomiques (composés de plusieurs atomes), il s'agit alors de parties de molécules.
En effet, certaines molécules ont des liaisons plus fragiles qui peuvent se rompre. Souvent, la rupture d'un telle liaison est la conséquence d'une différence d'électronégativité assez importante entre deux atomes. La rupture se réalise alors de façon hétérolytique : les deux électrons de la liaison se déplacent sur un atome. Cela génère deux fragments chargés (ions) :
- un de charge positive possédant l'atome qui a perdu son électron dans la rupture de liaison hétérolytique
- un de charge négative poss&dant l'atome qui a gagné un électron lors de la rupture.
Exemple :
H2SO4 → 2 H+ + SO4--
|
 |
Dans un premier temps, le plus facile est de pouvoir retenir les ions polyatomiques les plus courants ainsi que leur charge. Cela sert à construire facilement les structures moléculaires et à écrire les produits de réaction. Voici les ions classés par élément :
C
| HCO3- |
ion hydrogénocarbonate |
| CO3-- |
ion carbonate |
N
| NO2- |
ion nitrite |
| NO3- |
ion nitrate |
| NH4+ |
ion ammonium |
P
| H2PO4- |
ion dihydrogénophosphate |
|
| HPO4-- |
ion hydrogénophosphate |
| PO4--- |
ion phosphate |
| H2PO3- |
ion hydrogénophosphite |
|
| HPO3-- |
ion phosphite |
| H2PO2- |
ion hypophosphite |
S
| HSO3- |
ion hydrogénosulfite |
| SO3-- |
ion sulfite |
| HSO4- |
ion hydrogénosulfate |
| SO4-- |
ion sulfate |
| S2O3-- |
ion thiosulfate |
| HS- |
ion hydrogénosulfure |
Halogènes
| en général |
Nom |
Cl |
Br |
I |
| XO- |
ion hypohalogénite |
ClO- |
ion hypochlorite |
BrO- |
ion hypobromite |
IO- |
ion hypoiodite |
| XO2- |
ion halogénite |
ClO2- |
ion chlorite |
BrO2- |
ion bromite |
IO2- |
ion iodite |
| XO3- |
ion halogénate |
ClO3- |
ion chlorate |
BrO3- |
ion bromate |
IO3- |
ion iodate |
| XO4- |
ion perhalogénate |
ClO4- |
ion perchlorate |
BrO4- |
ion perbromate |
IO4- |
ion periodate |
C
| HCO3- |
ion hydrogénocarbonate |
| CO3-- |
ion carbonate |
N
| NO2- |
ion nitrite |
| NO3- |
ion nitrate |
| NH4+ |
ion ammonium |
P
| H2PO4- |
ion dihydrogénophosphate |
|
| HPO4-- |
ion hydrogénophosphate |
| PO4--- |
ion phosphate |
| H2PO3- |
ion hydrogénophosphite |
|
| HPO3-- |
ion phosphite |
| H2PO2- |
ion hypophosphite |
S
| HSO3- |
ion hydrogénosulfite |
| SO3-- |
ion sulfite |
| HSO4- |
ion hydrogénosulfate |
| SO4-- |
ion sulfate |
| S2O3-- |
ion thiosulfate |
| HS- |
ion hydrogénosulfure |
Halogènes
| en général |
Nom |
Cl |
Br |
I |
| XO- |
ion hypohalogénite |
ClO- |
ion hypochlorite |
BrO- |
ion hypobromite |
IO- |
ion hypoiodite |
| XO2- |
ion halogénite |
ClO2- |
ion chlorite |
BrO2- |
ion bromite |
IO2- |
ion iodite |
| XO3- |
ion halogénate |
ClO3- |
ion chlorate |
BrO3- |
ion bromate |
IO3- |
ion iodate |
| XO4- |
ion perhalogénate |
ClO4- |
ion perchlorate |
BrO4- |
ion perbromate |
IO4- |
ion periodate |
Les fiches
Masse des molécules
 |
Le savoir-faire lié à la détermination de la masse des molécules consiste à :
- Identifier le nombre d'atome de chaque type présent dans la molécule à l'aide
- des nombres en indice qui suivent le symbole
- des nombres en indice qui suivent des parenthèses enfermant de symbole
- éventuellement pour les cristaux, du nombre qui se situe juste avant un " • "
qui détermine le nombre de molécule d'eau attachées à chaque molécule du corps
- Multiplier ce nombre par la masse atomique relative (T.P)
- Adapter l'unité si besoin :
- u.m.a pour la masse moléculaire
- g/mol pour la masse molaire
- aucune unité pour la masse relative
|
Moles, masse et masse molaire
 |
Deux possibilités : utiliser les formules ou la règle de trois.
Avantages et inconvénients
En utilisant des formules, il arrive souvent que l'on hésite sur la forme (il faut diviser ou multiplier). La règle de 3 est une règle des proportions logique et mise en place à partir de l'énoncé.
Dans les deux cas, identifier ce que l'on connait dans l'énoncé et ce que l'on cherche.
Avec les formules
- Identifier la ou les formules permettant de relier les données à l'inconnue. Si il faut plusieurs formules, les associer pour dégager une seule équation les reliant.
- Transformer l'équation afin d'obtenir inconnue = ....
- Remplir chaque paramètre par leur valeur en indiquant les unités.
- Réaliser le calcul et indiquer la réponse et l'unité.
Avec les règles de trois
Une règle de trois commence toujours par un rapport connu (une définition, un rapport donné dans l'énoncé).
Et se termine toujours par une relation contenant l'inconnue. Entre ces deux lignes, une ou plusieurs lignes modifient les paramètres de gauche ou de droite pour relier la première et la dernière ligne.
ex : Nous cherchons combien de moles il y a dans 4g de NaOH
1 mole ------ 40g (la MM de NaOH est de 40g/mole)
------- 4g (Nous cherchons le nombre de moles pour 4g)
Finalement, nous appliquons le rapport entre 40 et 4 (40/4=10) à l'autre côté : 1mole/10 = 0,1 mole.
|
Famille des molécules
 |
Le savoir-faire lié à la détermination de la famille des molécules nécessite d'avoir la formule moléculaire.
Il consiste à :
- Identifier le métal et le remplacer par le symbole "M"
- Identifier le non-métal et le remplacer par le symbole "X"
On ne remplace ni l'hydrogène, ni l'oxygène.
On ne note pas les indices qui indiquent le nombre de chacun des atomes présents dans la molécule.
|